സിട്രിക് ആസിഡ്
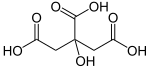
HOC(CO2H)(CH2CO2H)2 എന്ന രാസ സൂത്രവാക്യമുള്ള ഒരു ജൈവ സംയുക്തമാണ് സിട്രിക് ആസിഡ്.[9] ഇത് നിറമില്ലാത്ത, ദുർബലമായ ഓർഗാനിക് അമ്ലമാണ്.[9] സിട്രസ് പഴങ്ങളിൽ ഇത് സ്വാഭാവികമായി കാണപ്പെടുന്നു. ബയോകെമിസ്ട്രിയിൽ, ഇത് എല്ലാ എയറോബിക് ജീവികളുടെയും മെറ്റബോളിസത്തിൻറെ ഭാഗമായ സിട്രിക് ആസിഡ് സൈക്കിളിലെ ഒരു ഇന്റർമീഡിയറ്റാണ്. [9]
| |||
| Names | |||
|---|---|---|---|
| IUPAC name
Citric acid[1]
| |||
| Preferred IUPAC name
2-Hydroxypropane-1,2,3-tricarboxylic acid[1] | |||
| Identifiers | |||
3D model (JSmol)
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| DrugBank | |||
| ECHA InfoCard | 100.000.973 | ||
| EC Number |
| ||
| E number | E330 (antioxidants, ...) | ||
| KEGG | |||
PubChem CID
|
|||
| RTECS number |
| ||
| UNII | |||
CompTox Dashboard (EPA)
|
|||
| InChI | |||
| SMILES | |||
| Properties | |||
| തന്മാത്രാ വാക്യം | |||
| Molar mass | 0 g mol−1 | ||
| Appearance | white solid | ||
| Odor | Odorless | ||
| സാന്ദ്രത | 1.665 g/cm3 (anhydrous) 1.542 g/cm3 (18 °C, monohydrate) | ||
| ദ്രവണാങ്കം | |||
| ക്വഥനാങ്കം | |||
| 54% w/w (10 °C) 59.2% w/w (20 °C) 64.3% w/w (30 °C) 68.6% w/w (40 °C) 70.9% w/w (50 °C) 73.5% w/w (60 °C) 76.2% w/w (70 °C) 78.8% w/w (80 °C) 81.4% w/w (90 °C) 84% w/w (100 °C)[4] | |||
| Solubility | Soluble in acetone, alcohol, ether, ethyl acetate, DMSO Insoluble in C 6H 6, CHCl3, CS2, toluene[3] | ||
| Solubility in ethanol | 62 g/100 g (25 °C)[3] | ||
| Solubility in amyl acetate | 4.41 g/100 g (25 °C)[3] | ||
| Solubility in diethyl ether | 1.05 g/100 g (25 °C)[3] | ||
| Solubility in 1,4-Dioxane | 35.9 g/100 g (25 °C)[3] | ||
| log P | −1.64 | ||
| അമ്ലത്വം (pKa) | pKa1 = 3.13[5] pKa2 = 4.76[5] pKa3 = 6.39,[6] 6.40[7] | ||
| Refractive index (nD) | 1.493–1.509 (20 °C)[4] 1.46 (150 °C)[3] | ||
| വിസ്കോസിറ്റി | 6.5 cP (50% aq. sol.)[4] | ||
| Structure | |||
| Monoclinic | |||
| Thermochemistry | |||
| Std enthalpy of formation ΔfH |
−1543.8 kJ/mol[4] | ||
| Standard molar entropy S |
252.1 J/(mol·K)[8] | ||
| Specific heat capacity, C | 226.51 J/(mol·K) (26.85 °C)[8] | ||
| Hazards | |||
| Main hazards | Skin and eye corrosion | ||
| Safety data sheet | HMDB | ||
| GHS pictograms |  [5] [5]
| ||
| GHS Signal word | Danger | ||
| H319[5] | |||
| P305+351+338[5] | |||
| Flash point | {{{value}}} | ||
| Explosive limits | 8%[5] | ||
| Lethal dose or concentration (LD, LC): | |||
LD50 (median dose)
|
3000 mg/kg (rats, oral) | ||
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
| |||
പ്രതിവർഷം രണ്ട് ദശലക്ഷം ടൺ സിട്രിക് ആസിഡ് നിർമ്മിക്കപ്പെടുന്നു. ഇത് ഒരു അസിഡിഫയർ, സുഗന്ധം, കീലേറ്റിങ് ഏജന്റ് എന്നീ നിലകളിൽ വ്യാപകമായി ഉപയോഗിക്കുന്നു.[10]
സിട്രിക് ആസിഡിൽ നിന്നാണ് സിട്രേറ്റ് ഉണ്ടാവുന്നത്. ഇവ അകാർബണിക ലവണങ്ങൾ, എസ്റ്ററുകൾ, പോളിഅറ്റോമിക് അയോൺ എന്നിവയാകാം. ഉദാഹരണത്തിന്, ട്രൈസോഡിയം സിട്രേറ്റ് ഒരു ലവണം ആണ്. ട്രൈഈഥൈൽ സിട്രേറ്റ് ഒരു എസ്റ്റർ. ഒരു ലവണത്തിന്റെ ഭാഗമാകുമ്പോൾ, സിട്രേറ്റ് അയോണിന്റെ സൂത്രവാക്യം C
6H
5O3−
7 or C
3H
5O(COO)3−
3 എന്ന് എഴുതുന്നു.
കണ്ടെത്തലും ഉൽപ്പാദനവും
തിരുത്തുകപലതരം പഴങ്ങളിലും പച്ചക്കറികളിലും പ്രത്യേകിച്ച് സിട്രസ് പഴങ്ങളിൽ സിട്രിക് ആസിഡ് ഉണ്ട്. നാരങ്ങയിലും സിട്രസ് പഴങ്ങളിലും ആസിഡിന്റെ ഉയർന്ന സാന്ദ്രതയുണ്ട്. ഉണങ്ങിയ പഴങ്ങളിൽ ഭാരത്തിന്റെ 8% വരെ ഇത് ഉൾക്കൊള്ളുന്നു (ഏകദേശം 47 g/L ജ്യൂസുകളിൽ[11]).[a] സിട്രസ് പഴങ്ങളിൽ സിട്രിക് ആസിഡിന്റെ സാന്ദ്രത 0.005 mol/L മുതൽ ഓറഞ്ചിനും മുന്തിരിപ്പഴത്തിനും 0.005 mol/L വരെയാണ്. നാരങ്ങയിലും സിട്രസ് പഴങ്ങളിലും 0.30 mol/L വരെയും. ഈ മൂല്യങ്ങൾ വർഗ്ഗങ്ങൾക്കനുസരിച്ചും പഴങ്ങൾ വളരുന്ന സാഹചര്യങ്ങൾക്കനുസരിച്ചും വ്യത്യാസപ്പെട്ടിരിക്കുന്നു.
1784-ൽ രസതന്ത്രജ്ഞനായ കാൾ വിൽഹെം ഷീലെയാണ് സിട്രിക് ആസിഡ് ആദ്യമായി വേർതിരിച്ചെടുത്തത്. അദ്ദേഹം അതിനെ നാരങ്ങാനീരിൽ നിന്ന് ക്രിസ്റ്റലൈസ് ചെയ്തു.[12][13]
ഇറ്റാലിയൻ സിട്രസ് പഴ വ്യവസായത്തെ അടിസ്ഥാനമാക്കി 1890-ൽ വ്യാവസായിക തോതിലുള്ള സിട്രിക് ആസിഡ് ഉൽപ്പാദനം ആരംഭിച്ചു. ജലാംശം ഉള്ള ചുണ്ണാന്പു (കാൽസ്യം ഹൈഡ്രോക്സൈഡ്) ചേർത്ത് നാരങ്ങാനീരിൽ നിന്ന് കാത്സ്യം സിട്രേറ്റ് ഖരപദാർഥമായി വേർതിരിച്ചെടുത്തു.. ഈ അവക്ഷിപ്തത്തെ നേർപ്പിച്ച സൾഫ്യൂറിക് ആസിഡ് ഉപയോഗിച്ച് വീണ്ടും ആസിഡാക്കി മാറ്റി. [14]1893-ൽ സി. വെഹ്മർ പെൻസിലിയം പൂപ്പലിന് പഞ്ചസാരയിൽ നിന്ന് സിട്രിക് ആസിഡ് ഉത്പാദിപ്പിക്കാൻ കഴിയുമെന്ന് കണ്ടെത്തി. എന്നിരുന്നാലും, ഒന്നാം ലോകമഹായുദ്ധം ഇറ്റാലിയൻ സിട്രസ് കയറ്റുമതിയെ തടസ്സപ്പെടുത്തുന്നതുവരെ സിട്രിക് ആസിഡിന്റെ മൈക്രോബിയൽ ഉത്പാദനം വ്യാവസായികമായി പ്രധാനമായിരുന്നില്ല.
1917-ൽ അമേരിക്കൻ ഭക്ഷ്യ രസതന്ത്രജ്ഞനായ ജെയിംസ് ക്യൂറി, ആസ്പർജില്ലസ് നൈജർ എന്ന പൂപ്പൽ ഉപയോഗിച്ച് കാര്യക്ഷമമായ രീതിയിൽ സിട്രിക് ആസിഡ് ഉത്പാദിപ്പിക്കാമെന്ന് കണ്ടെത്തി. രണ്ട് വർഷത്തിന് ശേഷം ഫാർമസ്യൂട്ടിക്കൽ കമ്പനിയായ ഫൈസർ ഈ സാങ്കേതികവിദ്യ ഉപയോഗിച്ച് വ്യാവസായിക തലത്തിൽ ഉത്പാദനം ആരംഭിച്ചു. തുടർന്ന് 1929-ൽ സിട്രിക് ബെൽഗെയും ഉത്പാദനം ആരംഭിച്ചു. ഇന്നും വ്യാവസായികതലത്തിൽ സിട്രിക് ആസിഡ് ഉത്പാദനത്തിനുള്ള പ്രധാന രീതി എ. നൈജറിന്റെ കൾച്ചർ പഞ്ചസാര (സുക്രോസ്) അല്ലെങ്കിൽ ഗ്ലൂക്കോസ് അടങ്ങിയ മാധ്യമത്തിൽ വളർത്തിയെടുത്താണ്. പഞ്ചസാരയുടെ ഉറവിടം ഗോതമ്പ് ധാന്യം മദ്യം, മൊളാസസ്, ഹൈഡ്രോലൈസ്ഡ് കോൺ സ്റ്റാർച്ച് അല്ലെങ്കിൽ മറ്റ് വിലകുറഞ്ഞ, പഞ്ചസാര ലായനി എന്നിവയാണ്.[15] തത്ഫലമായുണ്ടാകുന്ന ലായനിയിൽ നിന്ന് പൂപ്പൽ ഫിൽട്ടർ ചെയ്ത ശേഷം, സിട്രിക് ആസിഡ്, കാൽസ്യം ഹൈഡ്രോക്സൈഡ് ഉപയോഗിച്ച് വേർപെടുത്തുമ്പോൾ കാൽസ്യം സിട്രേറ്റ് ലവണം ലഭിക്കുന്നു. അതിനുശേഷം കാൽസിയം സിട്രേറ്റിൽ നിന്ന് സൾഫ്യൂറിക് ആസിഡ് ഉപയോഗിച്ച് സിട്രിക് ആസിഡ് പുനർനിർമ്മിക്കുന്നു.
1977-ൽ, ലിവർ ബ്രദേഴ്സിന് സിട്രിക് ആസിഡിന്റെ രാസ സംശ്ലേഷണത്തിനുള്ള പേറ്റന്റ് ലഭിച്ചു. അക്കോണിറ്റിക് അല്ലെങ്കിൽ ഐസോസിട്രേറ്റ്/അലോഐസോസിട്രേറ്റുകളുടെ കാൽസ്യം ലവണങ്ങളെ ഉയർന്ന മർദ്ദത്തിനു വിധേയമാക്കിക്കൊണ്ടുള്ള പ്രക്രിയയാണ് ഇത്. പൂർണതോതിൽ സിട്രിക് ആസിഡ് ലഭ്യമാകുന്ന ഈ രീതി പ്രത്യക്ഷത്തിൽ ജൈവഎൻസൈമുകളുടെ സഹായമില്ലാതെ വിപരീതദിശയിൽ നടക്കുന്ന ക്രെബ്സ് സൈക്കിൾ റിയാക്ഷൻ ആണെന്നു തോന്നും. ( റിവേഴ്സ് നോൺ എൻസൈമാറ്റിക് ക്രെബ് സൈക്കിൾ റിയാക്ഷൻ) .[16]
2018-ൽ ആഗോള ഉൽപ്പാദനം 2,000,000 ടണ്ണിൽ അധികമായിരുന്നു.[17] ഈ വോളിയത്തിന്റെ 50% ത്തിലധികം ചൈനയിലാണ് നിർമ്മിച്ചത്. പാനീയങ്ങളിൽ അസിഡിറ്റി റെഗുലേറ്ററായി 50%, മറ്റ് ഭക്ഷണ പ്രയോഗങ്ങളിൽ 20%, ഡിറ്റർജന്റ് ആപ്ലിക്കേഷനുകൾക്കായി 20%, സൗന്ദര്യവർദ്ധക വസ്തുക്കൾ, ഫാർമസ്യൂട്ടിക്കൽസ്, കെമിക്കൽ വ്യവസായം എന്നിവയിൽ ഭക്ഷണം ഒഴികെയുള്ള പ്രയോഗങ്ങൾക്കായി 10% ഉപയോഗിച്ചു.[14]
സാന്നിദ്ധ്യം
തിരുത്തുകജൈവരസതന്ത്രം
തിരുത്തുകസിട്രിക് ആസിഡ് ചക്രം
തിരുത്തുകമറ്റ് ഉപയോഗങ്ങൾ
തിരുത്തുകപ്രയോജനങ്ങൾ
തിരുത്തുകഭക്ഷണവും വെള്ളവും
തിരുത്തുകശക്തമായ ഭക്ഷ്യയോഗ്യമായ ആസിഡുകളിൽ ഒന്നായതിനാൽ, സിട്രിക് ആസിഡിന്റെ പ്രബലമായ ഉപയോഗം ഭക്ഷണ പാനീയങ്ങളിൽ, പ്രത്യേകിച്ച് ശീതളപാനീയങ്ങളിലും മിഠായികളിലും സ്വാദ് വർദ്ധിപ്പിക്കാനും കേടു വരാതെ സൂക്ഷിക്കുന്ന വസ്തുവുമാണ്.[14] യൂറോപ്യൻ യൂണിയനിൽ ഇത് E സംഖ്യ E330 കൊണ്ട് സൂചിപ്പിക്കുന്നു. വിവിധ ലോഹങ്ങളുടെ സിട്രേറ്റ് ലവണങ്ങൾ ആ ധാതുക്കളെ ജൈവശാസ്ത്രപരമായി ലഭ്യമായ രൂപത്തിൽ പല ഭക്ഷണപദാർത്ഥങ്ങളിലും എത്തിക്കാൻ ഉപയോഗിക്കുന്നു. സിട്രിക് ആസിഡിൽ 100 ഗ്രാമിന് 247 കിലോ കലോറി ഉണ്ട്.[18] യുണൈറ്റഡ് സ്റ്റേറ്റ്സിൽ, യുണൈറ്റഡ് സ്റ്റേറ്റ്സ് ഫാർമക്കോപ്പിയ (യുഎസ്പി) പ്രസിദ്ധീകരിക്കുന്ന ഫുഡ് കെമിക്കൽസ് കോഡെക്സാണ് സിട്രിക് ആസിഡിനെ ഭക്ഷ്യ അഡിറ്റീവായി നിർവ്വചിച്ചിരിക്കുന്നത്.
കൊഴുപ്പ് വേർപെടുത്താതിരിക്കാൻ ഐസ്ക്രീമിൽ ഒരു എമൽസിഫൈയിംഗ് ഏജന്റായി സിട്രിക് ആസിഡ് ചേർക്കാം. സുക്രോസ് ക്രിസ്റ്റലൈസേഷൻ തടയാൻ പാചകക്കുറിപ്പുകളിൽ കാരമലിനു പകരം നാരങ്ങ നീര് ചേർക്കാം. സിട്രിക് ആസിഡ് സോഡിയം ബൈകാർബണേറ്റിനൊപ്പം വിപുലമായ രീതിയിൽ ഭക്ഷിക്കുന്നതിനും (ഉദാ. പൊടികളും ഗുളികകളും) വ്യക്തിഗത പരിചരണത്തിനും (ഉദാ: ബാത്ത് ലവണങ്ങൾ, ബാത്ത് ബോംബുകൾ, ഗ്രീസ് വൃത്തിയാക്കൽ) എഫർവെസൻറ്റ് ഫോർമുലകളിൽ ഉപയോഗിക്കുന്നു. ടേബിൾ ഉപ്പിന്റെ ഭൗതികമായ സാമ്യം കാരണം ഉണക്കി പൊടിച്ച രൂപത്തിൽ സിട്രിക് ആസിഡ് സാധാരണയായി വിപണികളിലും പലചരക്ക് സാധനങ്ങളിലും "പുളിരസമുള്ള ഉപ്പ്" എന്ന പേരിൽ വിൽക്കുന്നു. ശുദ്ധമായ ആസിഡ് ആവശ്യമുള്ള വിനാഗിരി അല്ലെങ്കിൽ നാരങ്ങ നീര് എന്നിവയ്ക്ക് പകരമായി ഇത് പാചക പ്രയോഗങ്ങളിൽ ഉപയോഗിക്കുന്നു. സാധാരണ അടിസ്ഥാന ചായത്തിന്റെ പിഎച്ച് നില സന്തുലിതമാക്കാൻ ഫുഡ് കളറിംഗിൽ സിട്രിക് ആസിഡ് ഉപയോഗിക്കാം.
ക്ലീനിംഗ് ആൻഡ് ചേലേറ്റിംഗ് ഏജന്റ്
തിരുത്തുകസിട്രിക് ആസിഡ് ഒരു മികച്ച ചേലേറ്റിംഗ് ഏജന്റാണ്. ലോഹങ്ങളുടെ ബന്ധനത്തിലൂടെ ഇതിനെ ലയിക്കാൻ സഹായിക്കുന്നു. ബോയിലറുകളിൽ നിന്നും ബാഷ്പീകരണ യന്ത്രങ്ങളിൽ നിന്നും കുമ്മായ സ്കെയിൽ അടിഞ്ഞുകൂടുന്നത് നീക്കം ചെയ്യാനും കുറയ്ക്കാനും ഇത് ഉപയോഗിക്കുന്നു.[14] വെള്ളം ശുദ്ധീകരിക്കാൻ ഇത് ഉപയോഗിക്കാം. ഇത് സോപ്പുകളുടെയും അലക്കൽ ഡിറ്റർജന്റുകളുടെയും ഫലപ്രാപ്തി മെച്ചപ്പെടുത്തുന്നതിന് ഉപയോഗപ്രദമാക്കുന്നു. കടുപ്പമുള്ള വെള്ളത്തിലെ ലോഹങ്ങളെ ചിലേറ്റ് ചെയ്ത് ക്ലീനർ നുരയെ ഉൽപ്പാദിപ്പിക്കുകയും വെള്ളം മൃദുവാക്കാതെ നന്നായി പ്രവർത്തിക്കുകയും ചെയ്യുന്നു. ചില ബാത്ത്റൂം, അടുക്കള വൃത്തിയാക്കൽ ലിക്വിഡുകളിൽ സിട്രിക് ആസിഡ് സജീവ ഘടകമാണ്. സിട്രിക് ആസിഡിന്റെ ആറ് ശതമാനം സാന്ദ്രതയുള്ള ഒരു ലായനി സ്ക്രബ്ബ് ചെയ്യാതെ തന്നെ ഗ്ലാസിലെ കഠിനമായ വെള്ളത്തിന്റെ കറ നീക്കംചെയ്യും. മുടിയിൽ നിന്ന് മെഴുക്ക് കഴുകാനും കളർ ചെയ്യാനും ഷാംപൂവിൽ സിട്രിക് ആസിഡ് ഉപയോഗിക്കാം. 1940-കളിലെ മാൻഹട്ടൻ പ്രോജക്ടിന്റെ സമയത്ത് ലാന്തനൈഡുകളുടെ മൊത്തത്തിലുള്ള അയോൺ-എക്സ്ചേഞ്ച് വേർതിരിക്കലിനായി ഉപയോഗിച്ച ആദ്യത്തെ വിജയകരമായ എലുവന്റായിരുന്നു സിട്രിക് ആസിഡ്.[21] 1950-കളിൽ, അത് വളരെ കാര്യക്ഷമമായ[22] EDTA ഉപയോഗിച്ച് മാറ്റിസ്ഥാപിച്ചു.
വ്യവസായത്തിൽ, സ്റ്റീലിൽ നിന്നും തുരുമ്പ് അലിയിക്കുന്നതിനും കൂടാതെ സ്റ്റെയിൻലെസ് സ്റ്റീലുകളിൽ പാസ്സിവേറ്റ് ചെയ്യാനും ഇത് ഉപയോഗിക്കുന്നു.[23]
സുരക്ഷ
തിരുത്തുകഅവലംബം
തിരുത്തുക- ↑ 1.0 1.1 International Union of Pure and Applied Chemistry (2014). Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. The Royal Society of Chemistry. p. 747. doi:10.1039/9781849733069. ISBN 978-0-85404-182-4.
- ↑ CID 22230 from PubChem
- ↑ 3.0 3.1 3.2 3.3 3.4 3.5 3.6 "citric acid". chemister.ru. Archived from the original on November 29, 2014. Retrieved June 1, 2014.
- ↑ 4.0 4.1 4.2 4.3 CID 311 from PubChem
- ↑ 5.0 5.1 5.2 5.3 5.4 5.5 Fisher Scientific, Citric acid. Retrieved on 2014-06-02.
- ↑ "Data for Biochemical Research". ZirChrom Separations, Inc. Retrieved January 11, 2012.
- ↑ "Ionization Constants of Organic Acids". Michigan State University. Retrieved January 11, 2012.
- ↑ 8.0 8.1 Citric acid in Linstrom, P.J.; Mallard, W.G. (eds.) NIST Chemistry WebBook, NIST Standard Reference Database Number 69. National Institute of Standards and Technology, Gaithersburg MD. http://webbook.nist.gov (retrieved 2014-06-02)
- ↑ 9.0 9.1 9.2 https://pubchem.ncbi.nlm.nih.gov/compound/citric_acid/
- ↑ Apleblat, Alexander (2014). Citric acid. Springer. ISBN 978-3-319-11232-9.
- ↑ Penniston KL, Nakada SY, Holmes RP, Assimos DG (2008). "Quantitative Assessment of Citric Acid in Lemon Juice, Lime Juice, and Commercially-Available Fruit Juice Products". Journal of Endourology. 22 (3): 567–570. doi:10.1089/end.2007.0304. PMC 2637791. PMID 18290732.
- ↑ Scheele, Carl Wilhelm (1784). "Anmärkning om Citron-saft, samt sätt at crystallisera densamma" [Note about lemon juice, as well as ways to crystallize it]. Kungliga Vetenskaps Academiens Nya Handlingar [New Proceedings of the Royal Academy of Science]. 2nd series (in സ്വീഡിഷ്). 5: 105–109.
- ↑ Graham, Thomas (1842). Elements of chemistry, including the applications of the science in the arts. Hippolyte Baillière, foreign bookseller to the Royal College of Surgeons, and to the Royal Society, 219, Regent Street. p. 944. Retrieved June 4, 2010.
- ↑ 14.0 14.1 14.2 14.3 Verhoff, Frank H.; Bauweleers, Hugo (2005), "Citric Acid", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a07_103.pub3
{{citation}}: Cite has empty unknown parameter:|authors=(help) - ↑ Lotfy, Walid A.; Ghanem, Khaled M.; El-Helow, Ehab R. (2007). "Citric acid production by a novel Aspergillus niger isolate: II. Optimization of process parameters through statistical experimental designs". Bioresource Technology. 98 (18): 3470–3477. doi:10.1016/j.biortech.2006.11.032. PMID 17317159.
- ↑ US 4056567-V.Lamberti and E.Gutierrez
- ↑ "Global Citric Acid Markets Report, 2011-2018 & 2019-2024". prnewswire.com. 19 March 2019. Retrieved 28 October 2019.
- ↑ Greenfield, Heather; Southgate, D.A.T. (2003). Food Composition Data: Production, Management and Use. Rome: FAO. p. 146. ISBN 9789251049495.
- ↑ Xiang Hao, Yongge Wei, Shiwei Zhang (2001): "Synthesis, crystal structure and magnetic property of a binuclear iron(III) citrate complex". Transition Metal Chemistry, volume 26, issue 4, pages 384–387. doi:10.1023/A:1011055306645
- ↑ Shweky, Itzhak; Bino, Avi; Goldberg, David P.; Lippard, Stephen J. (1994). "Syntheses, Structures, and Magnetic Properties of Two Dinuclear Iron(III) Citrate Complexes". Inorganic Chemistry. 33 (23): 5161–5162. doi:10.1021/ic00101a001.
- ↑ JOHNSON, WARREN C.; QUILL, LAURENCE L.; DANIELS, FARRINGTON (1947-09-01). "Rare Earths Separation Developed on Manhattan Project". Chemical & Engineering News Archive. 25 (35): 2494. doi:10.1021/cen-v025n035.p2494. ISSN 0009-2347.
- ↑ Saleem, Muhammad Hamzah; Ali, Shafaqat; Rehman, Muzammal; Rizwan, Muhammad; Kamran, Muhammad; Mohamed, Ibrahim A.A.; Khan, Zaid; Bamagoos, Atif A.; Alharby, Hesham F.; Hakeem, Khalid Rehman; Liu, Lijun (2020-08-01). "Individual and combined application of EDTA and citric acid assisted phytoextraction of copper using jute (Corchorus capsularis L.) seedlings". Environmental Technology & Innovation (in ഇംഗ്ലീഷ്). 19: 100895. doi:10.1016/j.eti.2020.100895. ISSN 2352-1864. S2CID 219432688.
- ↑ "ASTM A967 / A967M - 17 Standard Specification for Chemical Passivation Treatments for Stainless Steel Parts". www.astm.org.
- ↑ This still does not make the lemon particularly strongly acidic. This is because, as a weak acid, most of the acid molecules are not dissociated so not contributing to acidity inside the lemon or its juice.