സിൽവർ സൾഫേറ്റ്
വെള്ളിയുടെ ഒരു അയോണിക് സംയുക്തമാണ് സിൽവർ സൾഫേറ്റ് (Ag2SO4). ഇത് സിൽവർ പ്ലേറ്റിംഗിൽ ഉപയോഗിക്കുന്നു. ഈ സൾഫേറ്റ് സാധാരണ ഉപയോഗത്തിലും സംഭരണത്തിലും സ്ഥിരതയുള്ളതാണ്, എന്നിരുന്നാലും വായുവിലേക്കോ പ്രകാശത്തിലേക്കോ എക്സ്പോഷർ ചെയ്യുന്നത് ഇതിനെ ഇരുണ്ടതാക്കുന്നു. ഇത് വെള്ളത്തിൽ മിതമായി ലയിക്കുന്നതാണ്.
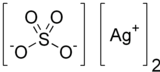
| |

| |
| Names | |
|---|---|
| IUPAC name
Silver sulfate
| |
| Other names
disilver sulfate
| |
| Identifiers | |
3D model (JSmol)
|
|
| ChemSpider | |
| ECHA InfoCard | 100.030.581 |
| EC Number |
|
PubChem CID
|
|
| UNII | |
| UN number | 3077 |
CompTox Dashboard (EPA)
|
|
| InChI | |
| SMILES | |
| Properties | |
| തന്മാത്രാ വാക്യം | |
| Molar mass | 0 g mol−1 |
| Appearance | Colorless crystals |
| Odor | Odorless |
| സാന്ദ്രത | 5.45 g/cm3 (25 °C) 4.84 g/cm3 (660 °C)[1] |
| ദ്രവണാങ്കം | |
| ക്വഥനാങ്കം | |
| 0.57 g/100 mL (0 °C) 0.69 g/100 mL (10 °C) 0.83 g/100 mL (25 °C) 0.96 g/100 mL (40 °C) 1.33 g/100 mL (100 °C)[2] | |
Solubility product (Ksp)
|
1.2·10−5[1] |
| Solubility | Dissolves in aq. acids, alcohols, acetone, ether, acetates, amides[2] Insoluble in ethanol[3] |
| Solubility in sulfuric acid | 8.4498 g/L (0.1 molH2SO4/LH2O)[2] 25.44 g/100 g (13 °C) 31.56 g/100 g (24.5 °C) 127.01 g/100 g (96 °C)[3] |
| Solubility in ethanol | 7.109 g/L (0.5 nEtOH/H2O)[2] |
| Solubility in acetic acid | 7.857 g/L (0.5 nAcOH/H2O)[2] |
| −9.29·10−5 cm3/mol[1] | |
| Refractive index (nD) | nα = 1.756 nβ = 1.775 nγ = 1.782[4] |
| Structure | |
| Orthorhombic, oF56[4] | |
| Fddd, No. 70[4] | |
| 2/m 2/m 2/m[4] | |
a = 10.2699(5) Å, b = 12.7069(7) Å, c = 5.8181(3) Å[4] α = 90°, β = 90°, γ = 90°
| |
| Thermochemistry | |
| Std enthalpy of formation ΔfH |
−715.9 kJ/mol[1] |
| Standard molar entropy S |
200.4 kJ/mol·K [1] |
| Specific heat capacity, C | 131.4 J/mol·K[1] |
| Hazards | |
| GHS pictograms |   [6] [6]
|
| GHS Signal word | Danger |
| H318, H410[6] | |
| P273, P280, P305+351+338, P501[6] | |
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
| |
തയ്യാറാക്കലും ഘടനയും
തിരുത്തുകസിൽവർ നൈട്രേറ്റിന്റെ ലായനിയിൽ സൾഫ്യൂറിക് ആസിഡ് ചേർത്ത് സിൽവർ സൾഫേറ്റ് തയ്യാറാക്കുന്നു:
- AgNO3 + H2SO4 → AgHSO4 + HNO3
- 2 AgHSO4 ⇌ Ag2SO4 + H2SO4
അൺഹൈഡ്രസ് സോഡിയം സൾഫേറ്റിനായി കാണപ്പെടുന്ന ഘടനയാണ് സംയുക്തം സ്വീകരിക്കുന്നത്. [7]
അവലംബം
തിരുത്തുക- ↑ 1.0 1.1 1.2 1.3 1.4 1.5 1.6 Lide, David R., ed. (2009). CRC Handbook of Chemistry and Physics (90th ed.). Boca Raton, Florida: CRC Press. ISBN 978-1-4200-9084-0.
- ↑ 2.0 2.1 2.2 2.3 2.4 Seidell, Atherton; Linke, William F. (1919). Solubilities of Inorganic and Organic Compounds (2nd ed.). New York: D. Van Nostrand Company. pp. 622–623.
- ↑ 3.0 3.1 3.2 Anatolievich, Kiper Ruslan. "silver sulfate". Retrieved 2014-07-19.
- ↑ 4.0 4.1 4.2 4.3 4.4 Morris, Marlene C.; McMurdie, Howard F.; Evans, Eloise H.; Paretzkin, Boris; Groot, Johan H. de; Hubbard, Camden R.; Carmel, Simon J. (June 1976). "13". Standard X-ray Diffraction Powder Patterns. Vol. 25. Washington: Institute for Materials Research National Bureau of Standards.
- ↑ 5.0 5.1 5.2 "MSDS of Silver sulfate". Fisher Scientific, Inc. Retrieved 2014-07-19.
- ↑ 6.0 6.1 6.2 Sigma-Aldrich Co., Silver sulfate. Retrieved on 2014-07-19.
- ↑ Zachariasen, W. H. (1932). "Note on the Crystal Structure of Silver Sulphate, Ag2SO4". Zeitschrift für Kristallographie - Crystalline Materials. 82 (1–6). doi:10.1524/zkri.1932.82.1.161.