ഗ്ലൂക്കോസ്
മനുഷ്യശരീരത്തിൽ ) ഊർജ്ജോൽപ്പാദനത്തിന് സഹായിക്കുന്ന ഏറ്റവും ലഘുവായ[4] കാർബോഹൈഡ്രേറ്റാണ് ഗ്ലൂക്കോസ്(/ˈɡluːkoʊs/ അല്ലെങ്കിൽ /-koʊz/; C6H12O6, ഡി-ഗ്ലൂക്കോസ്, ഡെക്സ്ട്രോസ്, ഗ്രേപ്പ് ഷുഗർ എന്നും അറിയപ്പെടുന്നു.). കോശങ്ങൾ ഇതിനെ പ്രഥമ ഊർജ്ജമായി ഉപയോഗിക്കുന്നു[5]. ഇതിനെ വിഘടിപ്പിക്കുവാൻ സാധ്യമല്ല. ഇതിൽ ഹൈഡ്രജന്റേയും, ഓക്സിജന്റേയും അംശബന്ധം 2:1 ആണ്.
 Skeletal formula of d-glucose
| |
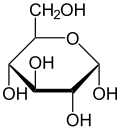 Haworth projection of α-d-glucopyranose
| |
 Fischer projection of d-glucose
| |
| Names | |
|---|---|
| Pronunciation | /ˈɡluːkoʊz/, /ɡluːkoʊs/ |
| IUPAC name
Allowed trivial names:[1]
| |
| Preferred IUPAC name
PINs are not identified for natural products. | |
Systematic IUPAC name
| |
| Other names
Blood sugars
Dextrose Corn sugar d-Glucose Grape sugar | |
| Identifiers | |
3D model (JSmol)
|
|
| 3DMet | |
| Abbreviations | Glc |
| Beilstein Reference | 1281604 |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| EC Number |
|
| Gmelin Reference | 83256 |
| KEGG | |
| MeSH | {{{value}}} |
PubChem CID
|
|
| RTECS number |
|
| UNII |
|
| InChI | |
| SMILES | |
| Properties | |
| തന്മാത്രാ വാക്യം | |
| Molar mass | 0 g mol−1 |
| Appearance | White powder |
| സാന്ദ്രത | 1.54 g/cm3 |
| ദ്രവണാങ്കം | |
| 909 g/L (25 °C (77 °F)) | |
| −101.5×10−6 cm3/mol | |
| 10.5674 | |
| Thermochemistry | |
| Std enthalpy of formation ΔfH |
−1271 kJ/mol[2] |
| Standard molar entropy S |
209.2 J/(K·mol)[3] |
| Specific heat capacity, C | 218.6 J/(K·mol)[3] |
| Hazards | |
| Safety data sheet | ICSC 08655 |
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
| |
രാസസൂത്രം
തിരുത്തുക- C6H12O6
ആധിക്യം വരുത്തുന്ന രോഗങ്ങൾ
തിരുത്തുകപ്രമേഹം
തിരുത്തുകരക്തത്തിൽ ഗ്ലൂക്കോസിന്റെ അളവ് കൂടിയ അവസ്ഥക്കാണ് പ്രമേഹം എന്നു പറയുന്നത്. രക്തഗ്ലൂക്കോസിന്റെ അളവ് ഒരുപരിധിയിലധികമായാൽ മൂത്രത്തിൽ ഗ്ലൂക്കോസ് കണ്ടുതുടങ്ങും. രക്തത്തിൽ ഗ്ലൂക്കോസിന്റെ അളവു കൂടുന്നതോടെ ഇടക്കിടെ മൂത്രമൊഴിക്കൽ, കൂടിയ ദാഹം, വിശപ്പ് എന്നിവയാണ് സാധാരണ ലക്ഷണങ്ങൾ. ഇന്ന് ലോകത്ത് പ്രമേഹ ബാധിതരുടെ എണ്ണം ദിനം പ്രതി വർദ്ധിച്ചുവരുന്നു. ജീവിത രീതിയിലുള്ള അപാകതകളാണ് പ്രമേഹം പിടിപെടാനുള്ള പ്രധാന കാരണം. ലോകത്ത് 200 ദശലക്ഷത്തിനു മുകളിൽ ആൾക്കാർ പ്രമേഹബാധിതരാണ്. ഓരോ എട്ടു സെക്കൻഡിലും പ്രമേഹം കാരണം ഒരാൾ മരണമടയുന്നു. രക്തത്തിലെ പഞ്ചസാരയുടെ അളവ് പെട്ടെന്നു കൂടുകയും കുറയുകയും ചെയ്യുന്നതാണ് പലപ്പോഴും പ്രമേഹത്തെ അപകടകാരിയാക്കുന്നത്.
സാന്നിധ്യം തിരിച്ചറിയാനുള്ള പരീക്ഷണങ്ങൾ
തിരുത്തുകബനഡിക്ട് ലായനി ഉപയോഗിച്ച്
തിരുത്തുകടെസ്റ്റ് ട്യൂബിൽ ഏകദേശം 2മില്ലി.ലിറ്റർ ഗ്ലൂക്കോസ് ലായനി എടുക്കുന്നു. അതിലേക്ക് ഏതാനും തുള്ളി ബനഡിക്ട് ലായനി ചേർത്ത് ചൂടാക്കുമ്പോൾ പച്ച കലർന്ന മഞ്ഞ മുതൽ ചുവപ്പ് വരെ നിറം ലഭിക്കാം.
അമോണിയാക്കൽ സിൽവർ നൈട്രേറ്റ് ലായനി ഉപയോഗിച്ച്
തിരുത്തുകടെസ്റ്റ് ട്യൂബിൽ അല്പം ഗ്ലൂക്കോസ് ലായനി എടുക്കുന്നു. അതിലേക്ക് ഏതാനും തുള്ളി അമോണിയാക്കൽ സിൽവർ നൈട്രേറ്റ് ലായനി ചേർക്കുന്നു. അപ്പോൾ കറുപ്പ് നിറമുള്ള അവക്ഷിപ്തം ഉണ്ടാകുന്നു.
അവലംബം
തിരുത്തുക- ↑ Nomenclature of Carbohydrates (Recommendations 1996) | 2-Carb-2 Archived 27 August 2023 at the Wayback Machine.. iupac.qmul.ac.uk.
- ↑ Ponomarev, V. V.; Migarskaya, L. B. (1960), "Heats of combustion of some amino-acids", Russ. J. Phys. Chem. (Engl. Transl.), 34: 1182–83
- ↑ 3.0 3.1 Boerio-Goates, Juliana (1991), "Heat-capacity measurements and thermodynamic functions of crystalline α-D-glucose at temperatures from 10K to 340K", J. Chem. Thermodyn., 23 (5): 403–09, Bibcode:1991JChTh..23..403B, doi:10.1016/S0021-9614(05)80128-4
- ↑ McCreary, Jeremy (October 30, 2004). "Glucose". Glucose. Retrieved 2006-11-07.
- ↑ Clark, D. (1999), Basic Neurochemistry: Molecular, Cellular and Medical Aspects, Lippincott, pp. 637–670
{{citation}}: Unknown parameter|coauthors=ignored (|author=suggested) (help)
- Text book of Organic Chemistry by Bansal
പുറം കണ്ണികൾ
തിരുത്തുക