സിൽവർ ഫുൾമിനേറ്റ്
ഫുൾമിനിക് ആസിഡിന്റെ ഉയർന്ന സ്ഫോടനാത്മകമായ സിൽവർ ലവണമാണ് സിൽവർ ഫുൾമിനേറ്റ് (AgCNO). സിൽവർ ഫുൾമിനേറ്റ് ഒരു പ്രാഥമിക സ്ഫോടകമാണ്. ആഘാതം, ചൂട്, മർദ്ദം, വൈദ്യുതി എന്നിവയോടുള്ള തീവ്രമായ സംവേദനക്ഷമത കാരണം ഉപയോഗത്തിന് പരിമിതിയുണ്ട്. ചെറിയ അളവിൽപ്പോലും സംയോജിപ്പിക്കുമ്പോൾ സംയുക്തം ക്രമേണ സെൻസിറ്റീവ് ആയിത്തീരുന്നു. ഒരു തൂവൽ സ്പർശം കൊണ്ടുള്ള ആഘാതം അല്ലെങ്കിൽ ഒരു ചെറിയ സ്റ്റാറ്റിക് ഡിസ്ചാർജ് അതുമല്ലെങ്കിൽ ഒരുതുള്ളി വെള്ളം പോലും സ്ഫോടനത്തിന് കാരണമാകാം. സ്വന്തം ഭാരം കൊണ്ടുള്ള ആഘാതം മൂലം പൊട്ടിത്തെറിക്കാനുള്ള സംയുക്തത്തിന്റെ പ്രവണത കാരണം വലിയ അളവിൽ സമാഹരിക്കുന്നത് അസാധ്യമാണ്.
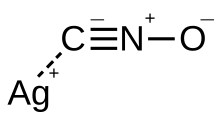
| |
| Names | |
|---|---|
| IUPAC names | |
| Other names
Silver fulminate
Silver(I) fulminate | |
| Identifiers | |
3D model (JSmol)
|
|
| ChemSpider | |
PubChem CID
|
|
CompTox Dashboard (EPA)
|
|
| InChI | |
| SMILES | |
| Properties | |
| തന്മാത്രാ വാക്യം | |
| Molar mass | 0 g mol−1 |
| സാന്ദ്രത | 3.938 g/cm3 |
| Explosive data | |
| Shock sensitivity | Extremely high |
| Friction sensitivity | Extremely high |
| Hazards | |
| Main hazards | Sensitive high explosive |
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
| |
1800 ൽ എഡ്വേർഡ് ചാൾസ് ഹോവാർഡ് ആണ്, തന്റെ ഗവേഷണ പദ്ധതിയിൽ സിൽവർ ഫുൾമിനേറ്റ് ആദ്യമായി തയ്യാറാക്കിയത്. മെർക്കുറി ഫുൾമിനേറ്റിനൊപ്പം, വാണിജ്യപരമായ ഉപയോഗത്തിന് മതിയായ ഒരേയൊരു ഫുൾമിനേറ്റ് ആണിത്. സിൽവർ ഫുൾമിനേറ്റ് ഡിറ്റണേറ്ററുകൾ 1885-ൽ ഉപയോഗിച്ചുവെങ്കിലും ഇറ്റാലിയൻ നാവികസേന മാത്രമാണ് ഇത് ഉപയോഗിച്ചിരുന്നത്. [3]
ഘടന
തിരുത്തുകസിൽവർ ഫുൾമിനേറ്റ് രണ്ട് പോളിമാർഫിക് രൂപങ്ങളിൽ സംഭവിക്കുന്നു, ഓർത്തോഹോംബിക് , റോംബോഹെഡ്രൽ ലാറ്റിസ് എന്നിവയാണവ.[4] ത്രികോണ പോളിമോർഫിൽ ചാക്രിക ഹെക്സാമറുകൾ അടങ്ങിയിരിക്കുന്നു, (AgCNO) 6 . [5]
പ്രോപ്പർട്ടികൾ
തിരുത്തുകഫുൾമിനേറ്റുകൾ വളരെ വിഷാംശം ഉള്ളവയാണ്. ഇവ സയനൈഡുകൾക്ക് തുല്യമാണ്. ശുദ്ധരൂപത്തിൽ, സിൽവർ ഫുൾമിനേറ്റ് രാസപരമായി വളരെ സ്ഥിരതയുള്ളതാണ്. വർഷങ്ങളുടെ സംഭരണത്തിനുശേഷവും വിഘടിക്കുന്നില്ല. പല വെള്ളി ലവണങ്ങൾ പോലെ, ഇത് നേരിയ എക്സ്പോഷർ ഉപയോഗിച്ച് ഇരുണ്ടതാക്കുന്നു. ഇത് തണുത്ത വെള്ളത്തിൽ അല്പം ലയിക്കുന്നതിനാൽ ചൂടുവെള്ളം ഉപയോഗിച്ച് ക്രിസ്റ്റൽ ഘടന പുനഃസ്ഥാപിക്കാൻ കഴിയും. [3] [6] അമോണിയം അസറ്റേറ്റിന്റെ 20% ലായനിയിലും ഇതിന്റെ ക്രിസ്റ്റൽ ഘടന പുനഃസ്ഥാപിക്കാം. ഇത് ഹൈഗ്രോസ്കോപ്പിക് അല്ല, നനവുള്ളതോ വെള്ളത്തിനടിയിലോ ആയിരിക്കുമ്പോൾ പൊട്ടിത്തെറിക്കും. 37 വർഷത്തിനുശേഷം വെള്ളത്തിനടിയിൽ ഇത് സ്ഫോടനാത്മകമായി തുടരുന്നതായി റിപ്പോർട്ടുണ്ട്. സാന്ദ്രീകൃത സൾഫ്യൂറിക് ആസിഡ് അല്ലെങ്കിൽ ക്ലോറിൻ അല്ലെങ്കിൽ ബ്രോമിൻ എന്നിവയുമായുള്ള സമ്പർക്കത്തിൽ ഇത് പൊട്ടിത്തെറിക്കുന്നു, പക്ഷേ അയോഡിനുമായി ബന്ധപ്പെടുമ്പോൾ സ്ഫോടനം നടക്കുന്നില്ല.. ഇത് നൈട്രിക് ആസിഡിൽ ലയിക്കില്ല, പക്ഷേ അമോണിയ, ആൽക്കലി ക്ലോറൈഡുകൾ, ആൽക്കലി സയനൈഡുകൾ, അനിലൈൻ, പിരിഡിൻ, പൊട്ടാസ്യം അയഡിഡ് എന്നിവയിൽ ലയിക്കുന്നു.
തയ്യാറാക്കൽ
തിരുത്തുകനൈട്രിക് ആസിഡിലെ സിൽവർ നൈട്രേറ്റിന്റെ ഒരു ലായനി, എഥനോളിൽ ഒഴിച്ച് ഈ സംയുക്തം തയ്യാറാക്കാം. [7] ഒരു സ്ഫോടനം ഒഴിവാക്കാൻ പ്രതിപ്രവർത്തന സാഹചര്യങ്ങളെ ശ്രദ്ധാപൂർവ്വം നിയന്ത്രിച്ച് പ്രവർത്തനം നടത്തുന്നു. [3] വളരെ ചെറിയ അളവിൽ സിൽവർ ഫുൾമിനേറ്റ് മാത്രമേ ഒരുതവണ തയ്യാറാക്കാനാവൂ, കാരണം പരലുകളുടെ ഭാരം പോലും സ്വയം പൊട്ടിത്തെറിക്കാൻ കാരണമാകും. സിൽവർ കാർബണേറ്റ് അമോണിയയുമായി പ്രതിപ്രവർത്തിക്കുക എന്നതാണ് സിൽവർ ഫുൾമിനേറ്റ് ഉണ്ടാക്കാനുള്ള മറ്റൊരു മാർഗം. </br>
നൈട്രജൻ ഓക്സൈഡ് വാതകം എഥനോളിലെ സിൽവർ നൈട്രേറ്റിന്റെ ലായനിയിലൂടെ കടന്നുപോകുമ്പോൾ സിൽവർ ഫുൾമിനേറ്റും രൂപം കൊള്ളുന്നു. [3]
പുതുമയുള്ള സ്ഫോടനാത്മകത
തിരുത്തുകസിൽവർ ഫുൾമിനേറ്റ്, പലപ്പോഴും പൊട്ടാസ്യം ക്ലോറേറ്റുമായി സംയോജിപ്പിച്ച്, "throw-downs", "crackers", "snappers", "whippersnappers", "pop-its", or "bang-snaps എന്നിങ്ങനെയറിയപ്പെടുന്ന പുതുമയുള്ള പടക്കങ്ങളിൽ ഉപയോഗിക്കുന്നു.
10-20% പൊട്ടാസ്യം ക്ലോറേറ്റ് അടങ്ങിയ ഒരു ഫുൾമിനേറ്റ് മിശ്രിതം ഫുൾമിനേറ്റിനേക്കാൾ വിലകുറഞ്ഞതും കൂടുതൽ തിളക്കമുള്ളതുമാണ്. [3]
ഇതും കാണുക
തിരുത്തുക- പ്രാഥമിക സ്ഫോടകവസ്തു
- ജസ്റ്റസ് വോൺ ലിബിഗ്
- ഫ്രീഡ്രിക്ക് വോഹ്ലർ
- സിൽവർ സയനേറ്റ്
- ഐസോമെറിസം
- ഫുൾമിനേറ്റ്
- ഫുൾമിനിക് ആസിഡ്
- പൊട്ടാസ്യം ഫുൾമിനേറ്റ്
- മെർക്കുറി (II) ഫുൾമിനേറ്റ്
- ഗാലിയം ഫുൾമിനേറ്റ്
പരാമർശങ്ങൾ
തിരുത്തുക- ↑ International Union of Pure and Applied Chemistry (2005). Nomenclature of Inorganic Chemistry (IUPAC Recommendations 2005). Cambridge (UK): RSC–IUPAC. ISBN 0-85404-438-8. p. 291. Electronic version.
- ↑ "Silver fulminate". ChemBase. Retrieved 8 June 2012.[പ്രവർത്തിക്കാത്ത കണ്ണി]
- ↑ 3.0 3.1 3.2 3.3 3.4 Matyas, Robert; Pachman, Jiri (Mar 12, 2013). Primary Explosives. Springer Science & Business Media, 338 pages.
- ↑ Britton, D.; Dunitz, J. D. (1965). "The Crystal Structure of Silver Fulminate". Acta Crystallographica. 19 (4): 662–668. doi:10.1107/S0365110X6500405X.
- ↑ Britton, D. (1991). "A Redetermination of the Trigonal Silver Fulminate Structure". Acta Crystallographica C. 47 (12): 2646–2647. doi:10.1107/S0108270191008855.
- ↑ .0075gm at 13C, .018gm at 30C, and .25gm per 100gm H20 at 100C
- ↑ Collins, P. H.; Holloway, K. J. (1978). "A Reappraisal of silver fulminate as a detonant". Propellants, Explosives, Pyrotechnics. 3 (6): 159–162. doi:10.1002/prep.19780030603.