സിൽവർ പെർക്ലോറേറ്റ്
AgClO4 എന്ന തന്മാത്രാസൂത്രമുള്ള രാസ സംയുക്തമാണ് സിൽവർ പെർക്ലോറേറ്റ് (Silver perchlorate). ഈ വെളുത്ത ഖരപദാർത്ഥം, ഒരു മോണോഹൈഡ്രേറ്റ് ഉണ്ടാക്കുന്നു. ഇത് നേരിയ തോതിൽ ദ്രവീകൃതമാണ്. പെർക്ലോറേറ്റിന്റെ സാന്നിദ്ധ്യം അപകടസാധ്യതകൾ കാണിക്കുന്നുണ്ടെങ്കിലും ഇത് Ag+ അയോണിന്റെ ഉപയോഗപ്രദമായ ഉറവിടമാണ്. ഓർഗാനിക് കെമിസ്ട്രിയിൽ ഇത് ഒരു ഉത്തേജകമായി ഉപയോഗിക്കുന്നു.
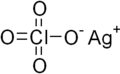
| |
| Names | |
|---|---|
| IUPAC name
Silver perchlorate
| |
| Other names
Perchloric acid, silver(1+) salt
| |
| Identifiers | |
| |
3D model (JSmol)
|
|
| ChemSpider | |
| ECHA InfoCard | 100.029.123 |
| EC Number |
|
PubChem CID
|
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| InChI | |
| SMILES | |
| Properties | |
| തന്മാത്രാ വാക്യം | |
| Molar mass | 0 g mol−1 |
| Appearance | Colorless hygroscopic crystals |
| സാന്ദ്രത | 2.806 g/cm3 |
| ദ്രവണാങ്കം | |
| 557 g/100 mL (25 °C) 792.8 g/100 mL (99 °C) | |
| Solubility | soluble in organic solvents |
| Structure | |
| cubic | |
| Hazards | |
| R-phrases | R8 R34 R50 |
| S-phrases | S15 S17 S26 S36/37/39 S45 |
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
| |
ഉത്പാദനം
തിരുത്തുകസിൽവർ നൈട്രേറ്റ് ഉപയോഗിച്ച് പെർക്ലോറിക് ആസിഡിന്റെ മിശ്രിതം ചൂടാക്കിയാണ് സിൽവർ പെർക്ലോറേറ്റ് സൃഷ്ടിക്കുന്നത്. ബേരിയം പെർക്ലോറേറ്റും സിൽവർ സൾഫേറ്റും തമ്മിലുള്ള പ്രതിപ്രവർത്തനത്തിലൂടെയോ അല്ലെങ്കിൽ സിൽവർ ഓക്സൈഡുള്ള പെർക്ലോറിക് ആസിഡിന്റെ പ്രതിപ്രവർത്തനത്തിലൂടെയോ ഇത് തയ്യാറാക്കാം .
ലേയത്വം
തിരുത്തുകസുഗന്ധമുള്ള ലായകങ്ങളായ ബെൻസീൻ (52.8 g/L), ടോളുവിൻ (1010 g/L) എന്നിവയിൽ ലയിക്കുന്നതിൽ സിൽവർ പെർക്ലോറേറ്റ് ശ്രദ്ധേയമാണ്. 100 മില്ലി വെള്ളത്തിന് 500 ഗ്രാം വരെ പദാർത്ഥത്തെ ലയിപ്പിക്കാനാവും. [1] [2] [3]
അവലംബം
തിരുത്തുക- ↑ F. Březina; J. Mollin; R. Pastorek; Z. Šindelář (1986). Chemické tabulky anorganických sloučenin [Chemical tables of inorganic compounds] (in Czech). Prague: SNTL.
{{cite book}}: CS1 maint: unrecognized language (link) - ↑ E. A. Hall Griffith; E. L. Amma (1974). "Metal Ion-Aromatic Complexes. XVIII. Preparation and Molecular Structure of Naphthalene-Tetrakis(silver perchlorate) Tetrahydrate". Journal of the American Chemical Society. 96 (3): 743–749. doi:10.1021/ja00810a018.
- ↑ R. K. McMullan; T. F. Koetzle; C. J. Fritchie Jr. (1997). "Low-Temperature Neutron Diffraction Study of the Silver Perchlorate–Benzene π Complex". Acta Crystallographica B. 53 (4): 645–653. doi:10.1107/S0108768197000712.