ബേറിയം അയോഡൈഡ്
രാസസംയുക്തം
(Barium iodide എന്ന താളിൽ നിന്നും തിരിച്ചുവിട്ടതു പ്രകാരം)
ഒരു അകാർബണിക രാസസംയുക്തമാണ് ബേറിയം അയോഡൈഡ് (Barium iodide). ഇതിന്റെ രാസസൂത്രം BaI2. നിർജ്ജലീയ രൂപത്തിലും ജലീയ രൂപത്തിലും ബേറിയം അയോഡൈഡ് കാണപ്പെടുന്നു (BaI2(H2O)2). ഇവ രണ്ടും വെള്ള നിറമുള്ള ഖരപദാർത്ഥമാണ്. ചൂടാക്കിയാൽ, ജലീയ സംയുക്തം നിർജ്ജലീയ സംയുക്തമായി മാറുന്നു. ജലീയ സംയുക്തം ജലം, എത്തനോൾ, അസറ്റോൺ എന്നിവയിൽ നന്നായി ലയിക്കുന്നു.
| |
| Names | |
|---|---|
| IUPAC name
Barium iodide
| |
| Other names
Barium iodide, anhydrous
| |
| Identifiers | |
| |
3D model (JSmol)
|
|
| ChemSpider | |
| ECHA InfoCard | 100.033.873 |
| EC Number |
|
PubChem CID
|
|
CompTox Dashboard (EPA)
|
|
| InChI | |
| SMILES | |
| Properties | |
| തന്മാത്രാ വാക്യം | |
| Molar mass | 0 g mol−1 |
| Appearance | White orthorhombic crystals (anhydrous) colorless crystals (dihydrate) |
| Odor | odorless |
| സാന്ദ്രത | 5.15 g/cm3 (anhydrous) 4.916 g/cm3 (dihydrate) |
| ദ്രവണാങ്കം | |
| 166.7 g/100 mL (0 °C) 221 g/100 mL (20 °C) 246.6 g/100 mL (70 °C) | |
| Solubility | soluble in ethanol, acetone |
| -124.0·10−6 cm3/mol | |
| Structure | |
| Orthorhombic, oP12, SpaceGroup = Pnma, No. 62 | |
| Thermochemistry | |
| Std enthalpy of formation ΔfH |
-602.1 kJ·mol−1 |
| Hazards | |
| Main hazards | toxic |
| Related compounds | |
| Other anions | barium fluoride barium chloride barium bromide |
| Other cations | beryllium iodide magnesium iodide calcium iodide strontium iodide |
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
| |
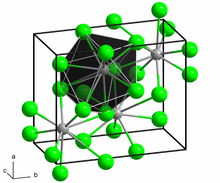
ഘടന
തിരുത്തുകഓരോ ബേറിയം ആറ്റവും 9 അയോഡൈഡ് അയോണുകളുമായി ചേരുന്നു[2]. ക്രിസ്റ്റൽ ഘടനയാണുള്ളത്. ഇതിന് ബേറിയം ക്ലോറൈഡ് (BaCl2) തന്മാത്രയുമായി സാദൃശ്യമുണ്ട്.[3]
രാസപ്രവർത്തനം
തിരുത്തുകബേരിയം ലോഹം 1,2-ഡൈഅയഡോ ഈഥേനുമായി പ്രവർത്തിക്കുമ്പോൾ നിർജ്ജലീയ ബേറിയം അയോഡൈഡ് (BaI2) ലഭിക്കുന്നു.[4]
BaI2 ആൽക്കൈൽ പൊട്ടാസ്യം സംയുക്തവുമായി പ്രവർത്തിച്ച് ഓർഗാനോ ബേറിയം സംയുക്തം ലഭിക്കുന്നു.[5]
സുരക്ഷ
തിരുത്തുകബേറിയം അയോഡൈഡ് ഒരു വിഷപദാർത്ഥമാണ്. അതിനാൽ, ശ്രദ്ധയോടെ കൈകാര്യം ചെയ്യണം.
അവലംബം
തിരുത്തുക- ↑ Lide, David R. (1998), Handbook of Chemistry and Physics (87 ed.), Boca Raton, FL: CRC Press, pp. 4–44, ISBN 0-8493-0594-2
- ↑ Wells, A.F. (1984) Structural Inorganic Chemistry, Oxford: Clarendon Press. ISBN 0-19-855370-6.
- ↑ Brackett, E. B.; Brackett, T. E.; Sass, R. L.; The Crystal Structures of Barium Chloride, Barium Bromide, and Barium Iodide. J. Phys. Chem., 1963, volume 67, 2132 – 2135
- ↑ Duval, E.; Zoltobroda, G.; Langlois, Y.; A new preparation of BaI2: application to (Z)-enol ether synthesis. Tetrahedron Letters, 2000, 41, 337-339
- ↑ Walter, M. D.; Wolmershauser, G.; Sitzmann, H.; Calcium, Strontium, Barium, and Ytterbium Complexes with Cyclooctatetraenyl or Cyclononatetraenyl Ligands. J. Am. Chem. Soc., 2005, 127 (49), 17494 – 17503.