സോഡിയം അലുമിനേറ്റ്
അലുമിനിയം ഹൈഡ്രോക്സൈഡിന്റെ ഫലപ്രദമായ ഉറവിടമായി ഉപയോഗിക്കുന്ന ഒരു അജൈവ സംയുക്തമാണ് സോഡിയം അലുമിനേറ്റ്. നിരവധി വ്യാവസായിക, സാങ്കേതിക ആവശ്യങ്ങൾക്കായി ഇതുപയോഗിക്കുന്നു. ശുദ്ധമായ അൺഹൈഡ്രസ് സോഡിയം അലൂമിനേറ്റ് വെളുത്ത പരൽരൂപമുള്ള ഖരപദാർത്ഥമാണ്. NaAlO2, NaAl(OH)4 (hydrated),[3] Na2O·Al2O3, or Na2Al2O4 എന്നിങ്ങനെ വ്യത്യസ്തമായ രാസസൂത്രമുള്ള സംയുക്തമാണിത്. വാണിജ്യപരമായ ആവശ്യങ്ങൾക്കുള്ള സോഡിയം അലുമിനേറ്റ് ഒരു ലായനിയായോ ഖരരൂപത്തിലോ ലഭ്യമാണ്. Na2O, Al2O3 എന്നിവയുടെ പ്രതിപ്രവർത്തനത്താൽ തയ്യാറാക്കപ്പെടുന്ന മറ്റ് അനുബന്ധ സംയുക്തങ്ങൾ Na5AlO4, Na17Al5O16, NaAl11O17 എന്നിവയാണ്. [4] [5]
 | |
 സോഡിയം മെറ്റാലൂമിനേറ്റ് സാമ്പിൾ
| |
| Names | |
|---|---|
| Other names
സോഡിയം അലുമിനിയം ഓക്സൈഡ്,
സോഡിയം മെറ്റാലുമിനേറ്റ് അലുമിനേറ്റ്, ((AlO2)1−), സോഡിയം | |
| Identifiers | |
3D model (JSmol)
|
|
| ECHA InfoCard | 100.013.728 |
| EC Number |
|
PubChem CID
|
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| InChI | |
| SMILES | |
| Properties | |
| തന്മാത്രാ വാക്യം | |
| Molar mass | 0 g mol−1 |
| Appearance | white powder (sometimes light-yellowish) hygroscopic/ when dissolved in water a colloidal black solution is formed |
| Odor | odorless |
| സാന്ദ്രത | 1.5 g/cm3 |
| ദ്രവണാങ്കം | |
| highly soluble | |
| Solubility | Insoluble in alcohol[2] |
| Refractive index (nD) | 1.566 |
| Structure | |
| orthorhombic | |
| Thermochemistry | |
| Std enthalpy of formation ΔfH |
-1133.2 kJ/mol |
| Standard molar entropy S |
70.4 J/mol K |
| Specific heat capacity, C | 73.6 J/mol K |
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
| |
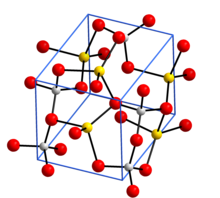
ഘടന
തിരുത്തുകAlO4 ടെട്രാഹെഡ്രയുടെ ത്രിമാന ചട്ടക്കൂട് ഉൾക്കൊള്ളുന്നതാണ് അൺഹൈഡ്രസ് സോഡിയം അലൂമിനേറ്റിൻറെ (NaAlO2) അടിസ്ഥാന ഘടന . NaAlO2 ·5/4H2O എന്ന ഹൈഡ്രേറ്റഡ് രൂപത്തിൽ AlO4 ടെട്രാഹെഡ്രൺ വളയങ്ങളായി യോജിപ്പിച്ചിരിക്കുന്ന പാളികളെ ഉറപ്പിച്ചു നിർത്തുന്നത് സോഡിയം അയോണുകളും ജല തന്മാത്രകളും ആണ് . AlO4 ടെട്രാഹെഡ്രയിലെ O ആറ്റങ്ങളുമായി ജല തന്മാത്രയിലെ ഹൈഡ്രജൻ ഭാഗിക ബന്ധനത്തിൽ ( Hydrogen bonding) ഏർപെടുന്നു. [6]
നിർമ്മാണം
തിരുത്തുകകാസ്റ്റിക് സോഡ (NaOH) ലായനിയിൽ അലുമിനിയം ഹൈഡ്രോക്സൈഡ് (Al(OH)3) ലയിപ്പിച്ചാണ് സോഡിയം അലുമിനേറ്റ് നിർമ്മിക്കുന്നത്. അലൂമിനിയം ഹൈഡ്രോക്സൈഡ് (gibbsite) 20-25% ജലീയ NaOH ലായനിയിൽ തിളനിലയ്ക്കടുത്തുള്ള താപനിലയിൽ ലയിപ്പിക്കാം. കൂടുതൽ സാന്ദ്രമായ NaOH ലായനി ഉപയോഗിച്ചാൽ ഒരു അർദ്ധ-ഖര ഉൽപ്പന്നമുണ്ടാകുന്നു. നീരാവിയിൽ ചൂടാക്കിയ നിക്കൽ അല്ലെങ്കിൽ സ്റ്റീൽ പാത്രങ്ങളിൽ ഈ പ്രക്രിയ നടത്തണം. കൂടാതെ അലുമിനിയം ഹൈഡ്രോക്സൈഡ്, ഒരു പൾപ്പ് രൂപപ്പെടുന്നത് വരെ ഏകദേശം 50% ജലീയ കാസ്റ്റിക് സോഡ ഉപയോഗിച്ച് തിളപ്പിക്കണം. അവസാന മിശ്രിതം ഒരു ടാങ്കിലേക്ക് ഒഴിച്ച് തണുപ്പിക്കണം; ഏകദേശം 70% NaAlO2 അടങ്ങിയ ഒരു ഖരപിണ്ഡം രൂപം കൊള്ളുന്നു. പൊടിച്ചതിനുശേഷം, ഈ ഉൽപ്പന്നം ഒരു റോട്ടറി ഓവനിൽ നിർജ്ജലീകരണം നടത്തുന്നു. ഇങ്ങനെയുണ്ടാകുന്ന ഉൽപ്പന്നത്തിൽ 90% NaAlO2 ഉം 1% ജലവും 1% സ്വതന്ത്ര NaOH ഉം അടങ്ങിയിരിക്കുന്നു.
അലുമിനിയം ലോഹത്തിന്റെയും ആൽക്കലിയുടെയും പ്രതിപ്രവർത്തനം
തിരുത്തുകസോഡിയം ഹൈഡ്രോക്സൈഡ് ഒരു ആംഫോട്ടറിക് ലോഹമായ മൂലക അലൂമിനിയത്തിൽ പ്രവർത്തിക്കുന്നതിലൂടെയും സോഡിയം അലുമിനേറ്റ് രൂപം കൊള്ളുന്നു. ഇതൊരു താപമോചക പ്രവർത്തനമാണ്. രാസപ്രവർത്തനഫലമായി ഹൈഡ്രജൻ വാതകം ഉണ്ടാകുന്നു:
- 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
എന്നാൽ, ലായനിയിൽ ഉൽപ്പാദിപ്പിക്കുമ്പോൾ, [Al(OH)4]− അയോൺ അല്ലെങ്കിൽ ഒരുപക്ഷേ [Al(H2O)2(OH)4]− അയോൺ അടങ്ങിയിരിക്കാൻ സാധ്യതയുണ്ട്.
ഉപയോഗം
തിരുത്തുകജലശുദ്ധീകരണ സംവിധാനങ്ങളിൽ സോഡിയം അലുമിനേറ്റ് ഏറെ പ്രയോജനപ്പെടുന്നു. കഠിനജലത്തെ മൃദുവാക്കാനും മലിനജലത്തിലേയും മറ്റു കുഴമ്പു പരുവത്തിലുള്ള ലായനികളിലേയും മാലിന്യത്തരികൾ പെട്ടെന്നു അടിഞ്ഞു കൂടാൻ (ഫ്ലോക്കുലേഷൻ, കൊയാഗുലേഷൻ ) സഹായിക്കുന്നതിനും വെള്ളത്തിൽ അലിഞ്ഞുചേർന്ന സിലിക്കയും ഫോസ്ഫേറ്റുകളും നീക്കം ചെയ്യുന്നതിനും ഇത് ഉപയോഗിക്കുന്നു.
കോൺക്രീറ്റിന്റെ ദൃഢീകരണം ത്വരിതപ്പെടുത്തുന്നതിന് സോഡിയം അലുമിനേറ്റ് ഉപയോഗിക്കുന്നു.
പേപ്പർ വ്യവസായം, ഫയർ ബ്രിക്ക് ഉത്പാദനം, അലുമിന ഉത്പാദനം തുടങ്ങിയവയിൽ സോഡിയം അലുമിനേറ്റ് ഉപയോഗിക്കുന്നു.
സിയോലൈറ്റുകളുടെ ഉത്പാദനത്തിൽ സോഡിയം അലുമിനേറ്റ് ലായനികൾ ഉപയോഗിക്കുന്നു[7][8].
ഇതും കാണുക
തിരുത്തുകഅവലംബം
തിരുത്തുക- ↑ Kaduk, James A.; Pei, Shiyou (1995). "The Crystal Structure of Hydrated Sodium Aluminate, NaAlO2•5/4H2O, and Its Dehydration Product". Journal of Solid State Chemistry. 115 (1): 126–139. doi:10.1006/jssc.1995.1111.
- ↑ The Merck Index. 10th ed. Rahway, New Jersey: Merck Co., Inc., 1983., p. 1229
- ↑ "Aluminium". chemguide.co.uk.
- ↑ "Identification and characterisation of three novel compounds in the sodium–aluminium–oxygen system", Marten G. Barker, Paul G. Gadd and Michael J. Begley, J. Chem.
- ↑ Egon Wiberg, Arnold Frederick Holleman (2001) Inorganic Chemistry, Elsevier ISBN 0-12-352651-5
- ↑ "The Crystal Structure of Hydrated Sodium Aluminate, NaAlO2·5/4H2O, and Its Dehydration Product", James A. Kaduk, Shiyou Pei, Journal of Solid State Chemistry, 115, 1, 1995, 126–139, doi:10.1006/jssc.1995.1111
- ↑ Lankapati, Henilkumar M.; Lathiya, Dharmesh R.; Choudhary, Lalita; Dalai, Ajay K.; Maheria, Kalpana C. (2020). "Mordenite-Type Zeolite from Waste Coal Fly Ash: Synthesis, Characterization and Its Application as a Sorbent in Metal Ions Removal". ChemistrySelect (in ഇംഗ്ലീഷ്). 5 (3): 1193–1198. doi:10.1002/slct.201903715.
- ↑ Alan Dyer, (1994), Encyclopedia of Inorganic Chemistry, R. Bruce King (ed.