സോഡിയം ഓക്സലേറ്റ്
ഓക്സാലിക് ആസിഡിന്റെ സോഡിയം ലവണമാണ് സോഡിയം ഓക്സലേറ്റ് അല്ലെങ്കിൽ ഡൈസോഡിയം ഓക്സലേറ്റ്. Na2C2O4 എന്ന രാസസൂത്രമുള്ള ഇത് 290 ഡിഗ്രി സെൽഷ്യസിനു മുകളിൽ വിഘടിക്കുന്ന, വെളുത്തതും സ്ഫടികരൂപത്തിലുള്ളതും മണമില്ലാത്തതുമായ ഒരു ഖരപദാർത്ഥമാണ്. [2]
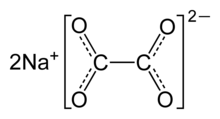
| |
| Names | |
|---|---|
| Preferred IUPAC name
Disodium oxalate | |
| Other names
Oxalic acid, disodium salt
Sodium ethanedioate | |
| Identifiers | |
3D model (JSmol)
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| ECHA InfoCard | 100.000.501 |
| EC Number |
|
PubChem CID
|
|
| RTECS number |
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| InChI | |
| SMILES | |
| Properties | |
| തന്മാത്രാ വാക്യം | |
| Molar mass | 0 g mol−1 |
| സാന്ദ്രത | 2.34 g cm−3 |
| ദ്രവണാങ്കം | |
| 2.69 g/100 mL (0 °C) 3.7 g/100 mL (20 °C) 6.25 g/100 mL (100 °C) | |
| Solubility | soluble in formic acid insoluble in alcohol, ether |
| Structure | |
| monoclinic | |
| Thermochemistry | |
| Std enthalpy of formation ΔfH |
-1318 kJ/mol |
| Hazards | |
| Safety data sheet | Oxford MSDS } |
| EU classification | {{{value}}} |
| Lethal dose or concentration (LD, LC): | |
LD50 (median dose)
|
11160 mg/kg (oral, rat)[1] |
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
| |
ഡിസോഡിയം ഓക്സലേറ്റിന് ഒരു റെഡ്യൂസിങ് ഏജന്റായി പ്രവർത്തിക്കാൻ കഴിയും.
മിനറൽ സോഡിയം ഓക്സലേറ്റ് വളരെ അപൂർവമായി മാത്രമേ കാണപ്പെടുന്നുള്ളൂ. അതും സോഡിയം വിനിമയത്തിന് സാധ്യതയേറുന്ന അതീവ ക്ഷാരസ്വഭാവമുള്ള (അൾട്രാ-ആൽക്കലൈൻ) പെഗ്മാറ്റൈറ്റുകളിൽ മാത്രം.
തയ്യാറാക്കൽ
തിരുത്തുകസോഡിയം ഹൈഡ്രോക്സൈഡ് (NaOH) ഉപയോഗിച്ച് ഓക്സാലിക് ആസിഡിന്റെ ന്യൂട്രലൈസേഷൻ വഴി സോഡിയം ഓക്സലേറ്റ് തയ്യാറാക്കാം. 200 മുതൽ 250 ഡിഗ്രി സെൽഷ്യസ് വരെ ചൂടാക്കി അൺഹൈഡ്രസ് ഓക്സലേറ്റ് തയാറാക്കുന്നു.[3] [2]
1:1 അനുപാതത്തിൽ NaOH ഉപയോഗിച്ച് പകുതി-ന്യൂട്രലൈസേഷൻ നടത്താം.
360 ഡിഗ്രി സെൽഷ്യസിൽ കൂടുതലുള്ള താപനിലയിൽ ചൂടാക്കി സോഡിയം ഫോർമേറ്റ് വിഘടിപ്പിച്ചും ഇത് നിർമ്മിക്കാം.
രാസപ്രവർത്തനങ്ങൾ
തിരുത്തുകസോഡിയം ഓക്സലേറ്റ് 290 ഡിഗ്രി സെൽഷ്യസിനു മുകളിൽ സോഡിയം കാർബണേറ്റും കാർബൺ മോണോക്സൈഡും ആയി വിഘടിക്കാൻ തുടങ്ങുന്നു: [2]
- Na
2C
2O
4 → Na
2CO
3 + CO
200 ഡിഗ്രി സെന്റിഗ്രേഡിനും 525 ഡിഗ്രി സെന്റിഗ്രേഡിനും ഇടയിൽ വനേഡിയം പെന്റോക്സൈഡുമായിച്ചേർത്ത് 1:2 മോളാർ അനുപാതത്തിൽ ചൂടാക്കുമ്പോൾ, സോഡിയം വനേഡിയം ഒക്സിബ്രോൺസ്, കാർബൺ ഡയോക്സൈഡ് എന്നിവയുണ്ടാകുന്നു.[4]
- x Na
2C
2O
4 + 2 V
2O
5 → 2 Na
xV
2O
5 + 2 x CO
2
ജൈവ പ്രവർത്തനം
തിരുത്തുകമറ്റ് പല ഓക്സലേറ്റുകളോയും പോലെ, സോഡിയം ഓക്സലേറ്റും മനുഷ്യർക്ക് വിഷമാണ്. ഇത് വായിലും തൊണ്ടയിലും വയറിലും കടുത്ത വേദന, രക്തത്തോടെയുള്ള ഛർദ്ദി, തലവേദന, പേശിവലിവ്, മലബന്ധം, ഹൃദയാഘാതം, രക്തസമ്മർദ്ദം കുറയൽ, ഹൃദയസ്തംഭനം, ഷോക്ക്, കോമ, മരണം എന്നിവയ്ക്ക് കാരണമാകും.
രക്തത്തിലെ പ്ലാസ്മയിൽ നിന്ന് കാൽസ്യം അയോണുകൾ (Ca 2+ ) നീക്കം ചെയ്യാൻ സിട്രേറ്റുകൾ പോലെ സോഡിയം ഓക്സലേറ്റ് ഉപയോഗിക്കാം. ഇത് രക്തം കട്ടപിടിക്കുന്നത് തടയുകയും ചെയ്യുന്നു. പക്ഷെ രക്തത്തിൽ നിന്ന് കാൽസ്യം അയോണുകൾ നീക്കം ചെയ്യുന്നതിലൂടെ സോഡിയം ഓക്സലേറ്റ് തലച്ചോറിന്റെ പ്രവർത്തനത്തെ തകരാറിലാക്കുകയും വൃക്കകളിൽ കാൽസ്യം ഓക്സലേറ്റ് നിക്ഷേപിക്കുകയും ചെയ്യും.
അവലംബം
തിരുത്തുക- ↑ 1.0 1.1 "ChemIDplus - 62-76-0 - ZNCPFRVNHGOPAG-UHFFFAOYSA-L - Disodium oxalate - Similar structures search, synonyms, formulas, resource links, and other chemical information". chem.nlm.nih.gov (in ഇംഗ്ലീഷ്). NIH. Retrieved 7 January 2019.
- ↑ 2.0 2.1 2.2 2.3 Yoshimori T1, Asano Y, Toriumi Y, Shiota T. (1978) "Investigation on the drying and decomposition of sodium oxalate".
- ↑ H. W. Foote and John E. Vance (1933), "The system; sodium iodate, sodium oxalate, water".
- ↑ D. Ballivet-Tkatchenko, J. Galy, -M. Savariault (1994): "Thermal decomposition of sodium oxalate in the presence of V2O5: Mechanistic approach of sodium oxibronzes formation".