കാൽസ്യം സയനൈഡ്
സയനൈഡിന്റെ കാൽസ്യം ലവണമാണ് കാൽസ്യം സയനൈഡ്. കറുത്ത സയനൈഡ് എന്നും ഇതറിയപ്പെടുന്നു. [2] , Ca(CN)2 എന്ന രാസസൂത്രത്തോടുകൂടിയ ഒരു അജൈവ സംയുക്തമാണിത്. ശുദ്ധമായ രൂപം വെളുത്ത ഖരമാണ്, പക്ഷേ, അത് അപൂർവ്വമായി മാത്രമേ കാണപ്പെടുന്നുള്ളു. വാണിജ്യ സാമ്പിളുകൾ കറുപ്പ്-ചാരനിറത്തിലാണ് ലഭ്യമാവുന്നത്. അത് ജലബാഷ്പത്തിന്റെ സാന്നിദ്ധ്യത്തിൽപ്പോലും ജലവിശ്ലേഷണം നടന്ന് ഇത് ഹൈഡ്രജൻ സയനൈഡ് പുറത്തുവിടുന്നു. സമാനമായ മറ്റ് സയനൈഡുകളെപ്പോലെ ഇതും മാരക വിഷമാണ് . [3]
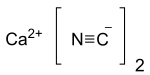
| |
| Names | |
|---|---|
| IUPAC name
calcium dicyanide
| |
| Systematic IUPAC name
calcium dicyanide | |
| Identifiers | |
3D model (JSmol)
|
|
| ChemSpider | |
| ECHA InfoCard | 100.008.856 |
| EC Number |
|
PubChem CID
|
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| InChI | |
| SMILES | |
| Properties | |
| തന്മാത്രാ വാക്യം | |
| Molar mass | 0 g mol−1 |
| Appearance | white powder |
| Odor | hydrogen cyanide |
| സാന്ദ്രത | 1.853 (20 °C) |
| ദ്രവണാങ്കം | |
| soluble | |
| Solubility | soluble in alcohol, weak acids |
| Structure | |
| rhombohedric | |
| Hazards | |
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
| |
തയ്യാറാക്കൽ
തിരുത്തുകപൊടിച്ച കാൽസ്യം ഓക്സൈഡ് തിളപ്പിച്ച അൺഹൈഡ്രസ് ഹൈഡ്രോസയാനിക് ആസിഡ് ഉപയോഗിച്ച് രാസപ്രവർത്തനം നടത്തി കാൽസ്യം സയനൈഡ് തയ്യാറാക്കാം. പോളിമറൈസേഷൻ വഴി ഹൈഡ്രോസയാനിക് ആസിഡിന്റെ നഷ്ടം കുറയ്ക്കുന്നതിന്, അമോണിയ അല്ലെങ്കിൽ ജലം പോലുള്ള ആക്സിലേറ്ററിന്റെ സാന്നിധ്യത്തിലാണ് പ്രവർത്തനം. ലിക്വിഡ് ഹൈഡ്രോസയാനിക് ആസിഡിനെ കാൽസ്യം കാർബൈഡുമായി പ്രതിപ്രവർത്തിച്ചും ഇത് തയ്യാറാക്കാം. 400° ഡിഗ്രി സെന്റിഗ്രേഡ് താപനിലയിൽ ഹൈഡ്രോസയാനിക് ആസിഡ് വാതകത്തെ ക്വിൿലൈം (CaO) ഉപയോഗിച്ച് പ്രതിപ്രവർത്തിച്ചും കാൽസ്യം സയനൈഡ് നിർമ്മിക്കാം. എന്നാൽ, 600 ഡിഗ്രി സെന്റിഗ്രേഡിന് മുകളിൽ, കാൽസ്യം സയാനിമിഡ് രൂപം കൊള്ളുന്നു. [4]
പ്രതിപ്രവർത്തനം
തിരുത്തുകകാൽസ്യം സയനൈഡ് ജലവിശ്ലേഷണം നടന്ന് ഹൈഡ്രജൻ സയനൈഡ് വാതകം രൂപപ്പെടുന്നു. ആസിഡിന്റെ സാന്നിധ്യം ഹൈഡ്രജൻ സയനൈഡ് വാതകത്തിന്റെ രൂപീകരണം ത്വരിതപ്പെടുത്തുന്നു. ഇത് ഓക്സിഡൈസിംഗ് ഏജന്റുകളോട് പ്രതിപ്രവർത്തിക്കുന്നു. അമോണിയം കാർബണേറ്റ് ഉപയോഗിച്ച് പ്രതിപ്രവർത്തിച്ച് അമോണിയം സയനൈഡ് ഉത്പാദിപ്പിക്കാനും കാൽസ്യം സയനൈഡ് ഉപയോഗിക്കുന്നു.
- Ca(CN)2 + (NH4 )2 CO3 → 2NH4CN + CaCO3
ഉപയോഗങ്ങൾ
തിരുത്തുകഖനന വ്യവസായത്തിൽ കാൽസ്യം സയനൈഡ് വ്യാപകമായി ഉപയോഗിക്കുന്നു. അയിരുകളിൽ നിന്ന് സ്വർണം, വെള്ളി തുടങ്ങിയ ലോഹങ്ങൾ വേർതിരിക്കുന്നതിന് സയനൈഡിന്റെ വിലകുറഞ്ഞ ഉറവിടമായി ഇത് പ്രവർത്തിക്കുന്നു. [5] അയിരുകളിൽ നിന്ന് വേർതിരിക്കുന്ന ലോഹങ്ങളുമായി ഏകോപന സമുച്ചയങ്ങൾ രൂപീകരിച്ചാണ് ഇത് ചെയ്യുന്നത്. [6] ഇത് സോളിഡ് ഫ്ലേക്ക് രൂപത്തിലോ ദ്രാവക രൂപത്തിലോ ലഭ്യമാവുന്നു. വിഷാംശമുള്ളതിനാൽ ഇതിനെ എലിവിഷം ആയും കീടനാശിനിയായും ഉപയോഗപ്പെടുത്തുന്നു.[7] [8] എന്നിരുന്നാലും ഇതിന്റെ ഉയർന്ന വിഷാംശം ഇത്തരം ആവശ്യങ്ങൾക്കുള്ള ഉപയോഗത്തെ പരിമിതപ്പെടുത്തുന്നു. ഹൈഡ്രജൻ സയനൈഡ്, അമോണിയം സയനൈഡ്, ഫെറോസയനൈഡുകൾ എന്നിവയുടെ നിർമ്മാണത്തിലും ഇത് ഉപയോഗിക്കുന്നു.
സുരക്ഷ
തിരുത്തുകമറ്റ് സയനൈഡ് ലവണങ്ങൾ പോലെ, കാൽസ്യം സയനൈഡ് വളരെ വിഷാംശം ഉള്ളവയാണ്. ഇക്കാരണത്താൽ, ഇതിന്റെ ഉപയോഗം കർശനമായി നിയന്ത്രിച്ചിരിക്കുന്നു.
അവലംബം
തിരുത്തുക- ↑ http://cameochemicals.noaa.gov/chemical/2775
- ↑ . "Calcium Cyanide." Merriam-Webster Dictionary. 2001. http://www.merriam-webster.com/dictionary/calcium%20cyanide (accessed April 22, 2012).
- ↑ Ernst Gail, Stephen Gos, Rupprecht Kulzer, Jürgen Lorösch, Andreas Rubo and Manfred Sauer "Cyano Compounds, Inorganic" Ullmann's Encyclopedia of Industrial Chemistry Wiley-VCH, Weinheim, 2004. doi:10.1002/14356007.a08_159.pub2
- ↑ . "Production of Hydrocyanic Acid" United States Patent Office. 1933.(accessed April 22, 2012).
- ↑ "Use of Cyanide for the Gold Industry" International Cyanide Management Code for the Use of Cyanide in the Gold . 2011. http://www.cyanidecode.org/cyanide_use.php Archived 2012-02-29 at the Wayback Machine. (accessed April 22, 2012).
- ↑ . "coordination compound" Encyclopædia Britannica. Encyclopædia Britannica Online Academic Edition. 2012. http://www.britannica.com/EBchecked/topic/136410/coordination-compound.
- ↑ . "Evaluation of Aluminium Phosphide Fumigation for the Control of Indian Crested Porcupine (Hystrix indica) in Scrublands*. 2008.
- ↑ . "CALCIUM CYANIDE FOR CHINCH-BUG CONTROL" UNIVERSITY OF ILLINOIS Agricultural Experiment Station. 1924.