താപഗതികം
താപോർജത്തെ മറ്റ് വിവിധ ഊർജ രൂപങ്ങളിലേക്കും (യാന്ത്രിക, രാസ, വൈദ്യുത ഊർജരൂപങ്ങളിലേക്ക്), മറ്റ് വിവിധ ഊർജങ്ങളെ താപോർജമായി മാറ്റം വരുത്തുന്നതിനേയും അതുമായി ബന്ധപ്പെട്ട വിഷയങ്ങളെയും പറ്റി പഠിക്കുന്ന ഭൗതികശാസ്ത്ര ശാഖയാണ് താപഗതികം (ആംഗലേയം: Thermodynamics).പദാർത്ഥനിബദ്ധമായശരീരം, വികിരണം എന്നിവയുടെ ശരാശരി ഗുണവിശേഷങ്ങളെ വിശദീകരിക്കുന്ന ബഹുതല ചരങ്ങളെ (ഊഷ്മാവ്, മർദ്ദം, വ്യാപ്തം പോലെയുള്ളവ) താപഗതികം നിർവചിക്കുന്നു. താപഗതികം ഒരിക്കലും പദാർത്ഥത്തിന്റെ ലഘുതല ഗുണവിശേഷങ്ങളെ കുറിച്ച് പ്രതിപാദിക്കുന്നില്ല. ലഘുതല ഗുണവിശേഷങ്ങളെ കുറിച്ച് പ്രതിപാദിക്കുന്ന ഭൗതികശാസ്ത്ര ശാഖയാണ് സാംഖ്യികബലതന്ത്രം.
ഇവിടെ താപം എന്നതുകൊണ്ട് "കൈമാറ്റത്തിലുള്ള ഊർജ്ജത്തെയും", ഗതികം എന്നതുകൊണ്ട് "ചലനാത്മകം" എന്നും അർത്ഥമാക്കുമ്പോൾ ഊർജ്ജത്തിന്റെ കൈമാറ്റത്തെയും അത് കൈമാറ്റം ചെയ്യപ്പെടുന്ന ഘട്ടങ്ങളുടെയും പഠനം താപഗതികത്തിൽ ഉൾപ്പെടുന്നു. ചരിത്രപരമായി താപഗതിക ശാഖയുടെ വികസനത്തിനു വഴിതെളിച്ചത് ആദ്യകാല നീരാവിയന്ത്രങ്ങളുടെ ദക്ഷത വർദ്ധിപ്പിക്കുന്നതിനു വേണ്ടിയുള്ള അന്വേഷണങ്ങളിൽ നിന്നാണ്. താപഗതിക തത്ത്വങ്ങളിലൂടെയാണ് ഈ ശാഖയുടെ പഠനത്തിന്റെ ആരംഭം. ഈ തത്ത്വങ്ങൾ പ്രകാരം ഊർജ്ജം താപത്തിന്റെയും പ്രവൃത്തിയുടെയും രൂപത്തിൽ ഭൗതിക വ്യുഹങ്ങൾക്കിടയിൽ കൈമാറ്റം ചെയ്യപ്പെടാൻ സാധിക്കും. ഇവ എൻട്രോപ്പി എന്ന ഒരു ഊർജ്ജത്തിന്റെ അവസ്ഥയെയും പ്രതിപാദിക്കുന്നുണ്ട്[1][2][3].
പ്രപഞ്ചത്തിന്റെ സൃഷ്ടി മുതൽ അതിൽ സംഭവിച്ചുകൊണ്ടിരിക്കുന്ന ഊർജ്ജക്കൈമാറ്റങ്ങൾ നടക്കുന്ന എല്ലാ പ്രതിഭാസങ്ങളേയും താപഗതികനിയമങ്ങളിലൂടെ വ്യാഖ്യാനിക്കാൻ സാധിക്കും. നക്ഷത്രങ്ങളുടേയും ഗ്യാലക്സിയുടേയും ഉല്പത്തിയും പരിണാമവും മുതൽ അതിസൂക്ഷ്മമായ ജീവകോശങ്ങളിലെ പ്രതിപ്രവർത്തനങ്ങൾ വരെ താപഗതികനിയമങ്ങൾക്കനുസരിച്ചാണു് നടക്കുന്നതു്.
താപഗതിക നിയമങ്ങൾ
തിരുത്തുകഎല്ലാ ഭൗതിക പ്രവർത്തനങ്ങളേയുംപോലെതന്നെ താപചലനവും ചില അടിസ്ഥാന നിയമങ്ങൾക്കു വിധേയമായിട്ടാണു നടക്കുന്നത്. ഈ താപഗതിക നിയമങ്ങൾ 19-ആം നൂറ്റാണ്ടിലാണ് ആവിഷ്കരിക്കപ്പെട്ടത്. എല്ലാ താപഗതിക പ്രക്രിയകളേയും അവയുടെ പരിമിതികളേയും വിശദീകരിക്കുന്നവയാണ് ഈ നിയമങ്ങൾ.
പൂജ്യാം താപഗതിക നിയമം
തിരുത്തുകതാപനില (temperature) എന്നതിന്റെ നിർവചനം നല്കുന്ന നിയമമാണിത്. താപഗതിക നിയമങ്ങളിൽ ഏറ്റവും അടിസ്ഥാനപരമായിട്ടുള്ളതും ഈ നിയമമാണ്. ഒന്നും രണ്ടും നിയമങ്ങൾ കണ്ടുപിടിച്ചതിനുശേഷം മാത്രമാണ് ഈ നിയമം കണ്ടുപിടിക്കപ്പെട്ടത്. എന്നാൽ പ്രാധാന്യമനുസരിച്ച് ഇത് ഒന്നും രണ്ടും നിയമങ്ങൾക്കു മുമ്പേ പ്രതിപാദിക്കേണ്ടിവരുന്നു. അതിനാലാണ് പൂജ്യം നിയമം (zeroth law) എന്ന പേരു വന്നത്. റാൽഫ് എച്ച്. ഫൗളർ എന്ന ബ്രിട്ടിഷ് ഗണിതശാസ്ത്രജ്ഞൻ 1931-ലാണ് ഈ നിയമം ആവിഷ്കരിച്ചത്.
രണ്ട് വസ്തുക്കൾ സന്തുലിതാവസ്ഥയിലായിരിക്കുമ്പോൾ അവ ഒരു പൊതുഗുണം ഉള്ളവയായിരിക്കും. അളക്കപ്പെടാവുന്നതും ഒരു നിശ്ചിത അക്കമൂല്യം സംസ്ഥാപിക്കപ്പെടാവുന്നതും ആയിരിക്കും ഈ ഗുണം. അതായത് "സന്തുലിതാവസ്ഥയിലിരിക്കുന്ന രണ്ട് വ്യൂഹങ്ങളിൽ ഓരോന്നും മൂന്നാമതൊരു വ്യൂഹവുമായി സന്തുലിതാവസ്ഥയിലാണെങ്കിൽ, ആദ്യത്തെ രണ്ട് വ്യൂഹങ്ങളും പരസ്പരം സന്തുലിതാവസ്ഥയിലായിരിക്കും. സന്തുലിതാവസ്ഥയുടെ ഈ പങ്കിടൽഗുണമാണ് 'താപനില' എന്നത്. ഇതാണ് താപഗതികത്തിലെ പൂജ്യം നിയമം (zeroth law). അതായത് വ്യൂഹങ്ങൾ A യും B യും സ്വതന്ത്രമായി C എന്ന വ്യൂഹത്തോട് സന്തുലിതാവസ്ഥയിലായിരുന്നാൽ A യും B യും താപീയമായി സന്തുലിതാവസ്ഥയിലായിരിക്കും.
TA = TC യും TB = TC യും ആയാൽ
TA = TB ആയിരിക്കും.
ഈ നിയമത്തിൽ താപനില അളക്കുന്നതിനെപ്പറ്റിയും ആ അളവിന്റെ അർഥമെന്താണ് എന്നതിനെപ്പറ്റിയുമുള്ള അടിസ്ഥാന ആശയങ്ങൾ ഉൾക്കൊണ്ടിട്ടുണ്ട്. ഇതിൽനിന്ന് ഒരു വസ്തുവിന്റെ 'താപനില'എന്നത് ആ വസ്തുവിന്റെ ഒരു ഗുണവിശേഷം ആണെന്നും, മറ്റുള്ള വസ്തുക്കളുമായി ബന്ധപ്പെടുമ്പോൾ താപസമതുലിതാവസ്ഥയാണോ താപക്കൈമാറ്റമാണോ ഉണ്ടാകുന്നത് എന്നു നിശ്ചയിക്കുന്നത് ഈ ഗുണവിശേഷം ആണെന്നും മനസ്സിലാക്കാം. ഈ നിയമത്തിലടങ്ങിയിട്ടുള്ള തത്ത്വമാണ് തെർമോമീറ്റർ ഉപയോഗിച്ച് ഒരു വസ്തുവിന്റെ താപനില അളക്കാൻ നാം ഉപയോഗപ്പെടുത്തുന്നത്. ഇവിടെ, തെർമോമീറ്ററിലെ ബൾബിന്റേയും വസ്തുവിന്റേയും താപനില ഒന്നുപോലെ ആകുന്നതുവരെ താപപ്രവാഹം നടക്കുന്നു.
ഒന്നാം താപഗതിക നിയമം
തിരുത്തുകതാപം എന്ന് സർവസാധാരണമായി ഉപയോഗിക്കുന്ന ആശയത്തിന്റെ നിർവചനം നല്കുന്നതാണ് താപഗതികത്തിന്റെ ഒന്നാം നിയമം. റഥർഫോർഡ്, ജൂൾ തുടങ്ങിയ ശാസ്ത്രജ്ഞർ നടത്തിയ പരീക്ഷണങ്ങളാണ് താപഗതികത്തിലെ ഒന്നാം നിയമത്തിന് അടിത്തറ പാകിയത്. അവരുടെ പരീക്ഷണങ്ങൾ W = JH എന്നു തെളിയിച്ചു. ഇതുതന്നെയാണ് ഒന്നാം നിയമവും. J എന്നത് താപത്തിന്റെ യാന്ത്രിക തുല്യാങ്കം (mechanical equivalent of heat) ആണ്. അതായത് 'ഏതെങ്കിലും ഒരു പ്രവൃത്തിയുടെ (W) ഫലമായി താപം (H) ജന്യമാകുകയാണ് എങ്കിൽ ഓരോ നിശ്ചിത മാത്ര താപമേ ജന്യമാവുകയുള്ളൂ. മറിച്ച്, താപോർജം പ്രവൃത്തിയായി രൂപാന്തരപ്പെടുകയാണ് എങ്കിൽ എല്ലായ്പ്പോഴും നിശ്ചിത അളവ് താപത്തിൽ നിന്ന് ഒരു നിശ്ചിത മാത്ര പ്രവൃത്തി മാത്രമേ ജന്യമാവുകയുള്ളൂ'.
സാർവത്രികമായ ഊർജസംരക്ഷണ നിയമത്തിന്റെ മറ്റൊരു ആവിഷ്കരണം മാത്രമാണ് താപഗതികത്തിന്റെ ഒന്നാം നിയമം. ഈ തത്ത്വപ്രകാരം ഊർജ്ജം നിർമ്മിക്കുവാനോ നശിപ്പിക്കുവാനോ സാധിക്കുകയില്ല. എന്നാൽ ഒരു രൂപത്തിൽ നിന്നു മറ്റൊരു രൂപത്തിലേക്ക് ഊർജ്ജത്തെ മാറ്റിയെടുക്കാം. ഒരു വസ്തുവിന് നാം കൊടുക്കുന്ന താപം സംരക്ഷിക്കപ്പെടുന്നു എന്നു സാരം; രൂപമാറ്റങ്ങൾ ഉണ്ടാകാം എന്നു മാത്രം. താപത്തിന്റെ ഏകകം (unit) കലോറിയും പ്രവൃത്തിയുടേയും ഊർജ്ജത്തിന്റെയും ഏകകം എർഗും ആണ്.
1 കലോറി = 4.186 × 107 എർഗ്
= 4.186 ജൂൾ ആണ്.
എല്ലാ യന്ത്രങ്ങളിലും കുറെയെങ്കിലും ഊർജ്ജം രൂപാന്തരപ്പെട്ടാണ് പ്രവൃത്തി (work) ഉണ്ടാകുന്നത്. ഒന്നാം നിയമം താപത്തെ ഊർജ ത്തിന്റെ ഒരു രൂപമായി കാണുകയും യാന്ത്രികപ്രവൃത്തിയായി (mechanical work) അതിനെ പരിവർത്തനപ്പെടുത്തുകയും ശേഖരി ച്ചുവയ്ക്കുകയും ചെയ്യാം എന്ന് അനുശാസിക്കുകയും ചെയ്യുന്നു. ഒരു വ്യൂഹത്തിലേക്കു മാറ്റിയ താപവും പ്രസ്തുത വ്യൂഹത്തിൽ ചെയ്ത പ്രവൃത്തിയും ചേർന്ന് വ്യൂഹത്തിന്റെ ആന്തരികോർജത്തിന്റെ (internal energy) വർധനവിനു കാരണമാകുന്നു. വ്യൂഹങ്ങൾ താപവും പ്രവൃത്തിയുമായി ഊർജങ്ങൾ പരസ്പരം കൈമാറ്റം ചെയ്യുന്നു എന്നു സാരം. ക്ളോഷിയസ് ഒന്നാം നിയമത്തെ ഇപ്രകാരം ക്രോഡീകരിച്ചിരിക്കുന്നു.
dQ = dU +dW
ഇവിടെ dQ നല്കപ്പെടുന്ന താപവും
dU യാന്ത്രികോർജ മാത്രയിലുള്ള വർധനവും
dW ചെയ്യപ്പെടുന്ന ബാഹ്യ പ്രവൃത്തിയുമാണ്.
രുദ്ധോഷ്മ വ്യതിയാനമാണെങ്കിൽ, dQ = 0
അതുകൊണ്ട് dU = -dW.
രണ്ടാം താപഗതിക നിയമം
തിരുത്തുകഎൻട്രോപ്പി എന്ന ഭൗതിക ഗുണവിശേഷത്തിന്റെ നിർവചനം നല്കുന്ന നിയമമാണിത്. എൻട്രോപ്പി എന്നത് ഒരു വ്യൂഹത്തിന്റെ ക്രമരാഹിത്യത്തിന്റെ (disorder) അളവാണ്. ഒറ്റപ്പെട്ട (isolated) ഒരു വ്യൂഹത്തിന്റെ എൻട്രോപ്പി ഒരിക്കലും കുറയുന്നില്ല എന്ന് രണ്ടാം നിയമം അനുശാസിക്കുന്നു. പ്രവൃത്തിയുടെ അഭാവത്തിൽ താപം താഴ്ന്ന നിലയിൽനിന്ന് ഉയർന്ന നിലയിലേക്കു മാറ്റം ചെയ്യപ്പെടുന്നില്ല എന്നും രണ്ടാം നിയമം വ്യവസ്ഥ ചെയ്യുന്നു.
രണ്ടാം നിയമം ഒരു സ്വാഭാവിക പ്രകൃതിനിയമം തന്നെയാണ്. യാന്ത്രിക തുല്യാങ്കവും താപവും തമ്മിൽ എപ്രകാരം ബന്ധപ്പെട്ടിരിക്കുന്നു എന്നു മാത്രമേ ഒന്നാം നിയമം വെളിപ്പെടുത്തുന്നുള്ളൂ. അല്ലാതെ ഇവയിൽ ഏതിൽ നിന്ന് ഏതിലേക്ക് പരിവർത്തനം നടക്കുന്നു എന്നോ ഈ പരിവർത്തനത്തിന്റെ പരിധി എന്തെന്നോ ഒന്നും പ്രതിപാദിക്കുന്നില്ല(kpq). ഇതിലേക്കുള്ള അന്വേഷണമാണ് രണ്ടാം നിയമത്തിന്റെ രൂപീകരണത്തിനു വഴിതെളിച്ചത്.
താപഗതികത്തിന്റെ രണ്ടാം നിയമം പലവിധത്തിൽ പ്രസ്താവിക്കാവുന്നതാണ്. ഇതിൽ ക്ളോഷിയസ്സിന്റെ നിർവചനം ഇപ്രകാരമാണ്: സ്വയം പ്രവർത്തിക്കുന്ന ഒരു യന്ത്രത്തിന് ബാഹ്യകാരക ത്തിന്റെ സഹായം കൂടാതെ ഒരു വസ്തുവിൽ നിന്നോ ഒരു ഭാഗത്തുനിന്നോ അതിനേക്കാൾ ഉയർന്ന താപനിലയിലുള്ള ഒന്നിലേക്ക് താപം പകരുവാൻ സാധ്യമല്ല. അല്ലെങ്കിൽ ഒരു തണുത്ത വസ്തുവിൽ നിന്ന് ചൂടു കൂടുതലുള്ള മറ്റൊന്നിലേക്ക് താപം സ്വയം പ്രവഹിക്കുന്നില്ല.എന്നാൽ ബാഹ്യപ്രവൃത്തിയുടെ സഹായത്തോടെ തണുത്ത വസ്തുവിൽ നിന്ന് ചൂടുള്ള വസ്തുവിലേക്ക് താപോർജം മാറ്റുവാൻ സാധിക്കും. (കുന്നിൽ ചുവട്ടിൽ നിന്ന് മുകളിലേക്ക് വെള്ളം പമ്പ് ചെയ്ത് കയറ്റുന്നതുപോലെ.)
താപോർജം യാന്ത്രികോർജമായി പരിവർത്തനം നടക്കുന്നത് ഏതൊക്കെ നിബന്ധനകൾക്കു വിധേയമായിട്ടാണ് എന്ന് രണ്ടാം നിയമം വിശദീകരിക്കുന്നു. ഈ നിയമപ്രകാരം താപോർജത്തെ പൂർണമായും യാന്ത്രികോർജമായി പരിവർത്തനപ്പെടുത്താൻ സാധിക്കുകയില്ല. ഒന്നും രണ്ടും താപഗതിക നിയമങ്ങളിൽ നിന്നാണ് എൻജിനീയറിങ്ങിലെ പ്രധാന താപഗതിക ബന്ധങ്ങൾ ഉരുത്തിരിഞ്ഞിട്ടുള്ളത്. ചക്രീയ (cyclic) സ്വഭാവമുളള്ള പ്രക്രിയകളിലൂടെ താപഗതികപ്രക്രിയകളെ വ്യാഖ്യാനിക്കാൻ കഴിയുന്നു. താപ എൻജിനുകളുടെ ദക്ഷത (efficiency) 100%-ൽ താഴെ ആയിരിക്കുമെന്നും രണ്ടാം നിയമം അനുശാസിക്കുന്നു. രണ്ടാം നിയമത്തേയും ഭൌതികസൈദ്ധാന്തികശാസ്ത്രജ്ഞർ താപഗതികത്തിലെ ഒന്നാം നിയമത്തേയും രണ്ടാം നിയമത്തേയും സംക്ഷിപ്തമായി ഇങ്ങനെയും നിർവചിക്കാറുണ്ട്:
1. ഒന്നാം നിയമം: "ഈ പ്രപഞ്ചത്തിലെ ആകെ ഊർജ്ജം സുസ്ഥിരമാണ്; അത് കൂടുകയോ കുറയുകയോ ഇല്ല.
2. രണ്ടാം നിയമം: "ഈ പ്രപഞ്ചത്തിലെ ആകെ എൻട്രോപ്പി കൂടിക്കൊണ്ടേ ഇരിക്കും.
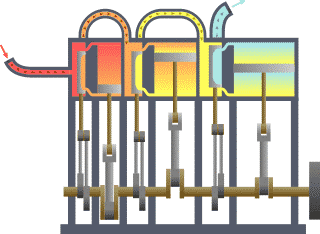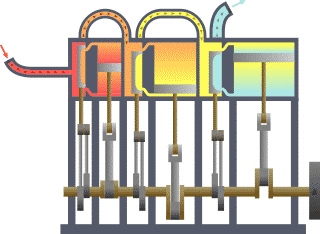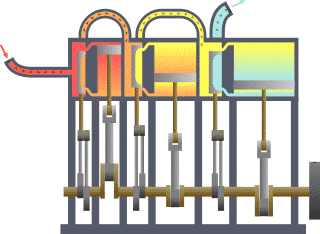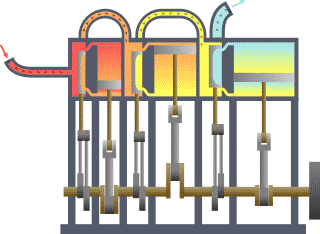
താപ എൻജിൻ (Heat engine). താപോർജത്തെ യാന്ത്രികോർജം (പ്രവൃത്തി) ആയി മാറ്റുന്നതിനുള്ള ഉപാധിയെയാണ് താപ എൻജിൻ എന്നു പറയുന്നത്. ഉദാ. ആവി എൻജിൻ, ആന്തരജ്വലന എൻജിൻ, ആവി ടർബൈൻ. ഒരു താപ എൻജിന് ഉണ്ടായിരിക്കേണ്ട മൂന്ന് ഘടകങ്ങൾ താഴെക്കൊടുക്കുന്നു:
1. താപസ്രോതസ്- ഉയർന്ന താപനിലയിൽ താപം പ്രദാനം ചെയ്യുന്ന ഒരു തപ്തവസ്തു.
2. സിങ്ക്-അവശിഷ്ട താപം സ്വീകരിക്കുന്ന താഴ്ന്ന താപ നിലയിലുള്ള തണുത്ത വസ്തു.
3. പ്രവർത്തന വസ്തു-താപസ്രോതസ്സിൽ നിന്ന് താപം സ്വീകരിച്ച് വികാസം വഴി താപത്തിന്റെ ഒരു ഭാഗം പ്രവൃത്തിയായി രൂപാന്തരപ്പെടുത്തുകയും ബാക്കിഭാഗം സിങ്കിലേക്കു തള്ളിക്കളയുകയും ചെയ്യുന്ന വസ്തു.
വ്യത്യസ്ത താപനിലകളുള്ള ഒരു സ്രോതസ്സിന്റേയും സിങ്കി ന്റേയും സഹായമില്ലാതെ താപത്തെ പ്രവൃത്തിയായി രൂപാന്തര പ്പെടുത്താൻ സാധ്യമല്ല.
താപ എൻജിന്റെ പ്രവർത്തനം പൊതുവേ മൂന്ന് ഘട്ടങ്ങളിലായിട്ടാണു നടക്കുന്നത്.
1-ാം ഘട്ടം: താപം ഉണ്ടാക്കൽ-ഇന്ധനം കത്തിച്ചോ രാസ, ഭൌതിക, ആണവ പ്രക്രിയകളാലോ ഇതു സാധിക്കുന്നു.
2-ാം ഘട്ടം: താപം ഉപയോഗിച്ച് ദ്രവത്തിന്റെ (ദ്രാവകമോ വാത കമോ) താപനില ഉയർത്തി മർദം വർധിപ്പിക്കൽ.
3-ാം ഘട്ടം: വർധിച്ച ഈ മർദം ഉപയോഗപ്പെടുത്തിക്കൊണ്ട്് ഉപയോഗപ്രദമായ യാന്ത്രിക ചലനങ്ങൾ സൃഷ്ടിക്കൽ.
താപ എൻജിനുകളുടെ പ്രക്രിയ ചക്രീയം (cyclic) ആകുന്നതിനാലാണ് തുടർച്ചയായി പ്രവൃത്തി ലഭ്യമാകുന്നത്. ഒരു ആദർശ (ideal) താപ എൻജിന്റെ ദക്ഷത (efficiency)η= W/JQ = 1 ആയിരിക്കും. എന്നാൽ യാഥാർഥത്തിൽ ദക്ഷത 1-ലും കുറവായിരിക്കും. സാധാരണ താപ എൻജിനുകളുടെ ദക്ഷത 5% മുതൽ 55% വരെ മാത്രമായാണു കണ്ടുവരുന്നത്. സാദി കാർനോ(Sadi Carnot)യുടെ പഠനങ്ങൾ ഈ രംഗത്ത് ശ്രദ്ധേയമാണ്.
മൂന്നാം താപഗതിക നിയമം
തിരുത്തുക"താപനില പൂജ്യത്തോട് അടുക്കുമ്പോൾ ഏതൊരു സമതാപീയ, ഉത്ക്രമണ പ്രക്രിയയോടു ബന്ധപ്പെട്ടുള്ള എൻട്രോപ്പി വ്യത്യാസവും പൂജ്യത്തോട് അടുക്കുന്നു. എന്നതാണ് താപഗതികത്തിന്റെ മൂന്നാം നിയമം. പൂജ്യം കെൽവിൽ താപനില എന്നാൽ മർദവും പൂജ്യമാകണം. ഒരു മാർഗ്ഗത്തിലൂടെയും കേവലപൂജ്യം (absolute zero)എന്ന താപനില കൈവരിക്കാൻ കഴിയില്ല എന്നു മൂന്നാം നിയമം അനുശാസിക്കുന്നു. കേവലപൂജ്യം എന്നത് അനന്ത സ്പർശിയായി മാത്രം എത്തിച്ചേരാൻ കഴിയാവുന്ന ഒരു താപനിലയായി മാറുന്നു. അതിനാൽ മൂന്നാം നിയമത്തെ മറ്റൊരു രീതിയിലും നിർവചിക്കാറുണ്ട്: 'പരിമിതമായ സംക്രിയകൾ കൊണ്ട് ഒരു വ്യൂഹത്തെ കേവലപൂജ്യ താപനിലയിലെത്തിക്കാൻ ഏതു പ്രവർത്തനക്രമം മൂലവും എന്തുമാത്രം ആദർശപരമാക്കിയതായാലും അസാധ്യമാണ്'. 'കേവലപൂജ്യത്തിന്റെ അപ്രാപ്യതാതത്ത്വം' എന്നും ഈ നിയമത്തെ വിശേഷിപ്പിക്കാറുണ്ട്. താഴ്ന്ന താപനിലാപഠനങ്ങളിലും താപപ്രക്രിയകളുടെ ദിശാനിർണയനത്തിലും താപഗതികത്തിന്റെ മൂന്നാം നിയമം പ്രയോജനപ്പെടുത്തുന്നു.
താപഗതിക ഫലനങ്ങൾ (Thermodynamic functions). മർദം, താപനില, വ്യാപ്തം, ദ്രവ്യമാനം (mass) എന്നീ നാല് താപഗതിക ഗുണധർമങ്ങളെ മാത്രമേ നേരിട്ട് അളക്കാൻ സാധിക്കുകയുള്ളൂ. ആന്തരികോർജം, എൻട്രോപ്പി മുതലായവ നേരിട്ട് അളക്കാൻ പറ്റാത്തവയാണ്. എന്നാൽ ഈ രണ്ട് വിഭാഗങ്ങളേയും ബന്ധിപ്പിക്കാൻ താപഗതിക ഫലനങ്ങൾക്കു കഴിയുന്നു. മാക്സ് വെൽ സമീകരണങ്ങൾ (Maxwell equations) ആണ് ഇതിനായി സാധാരണ ഉപയോഗിക്കുന്നത്.
സാംഖ്യിക താപഗതികം (Statistical Themodynamics). ക്ളാസ്സിക്കൽ താപഗതികവും തന്മാത്രാസിദ്ധാന്തവും യോജിപ്പി ച്ചുള്ള പഠനമേഖലയാണ് സാംഖ്യിക താപഗതികം. മാക്സ്വെൽ, ലുഡ്വിഗ്, ബോൾട്സ്മൻ, ഗിബ്സ് എന്നീ ശാസ്ത്രജ്ഞരാണ് ഈ ശാഖയുടെ പൊതുനിയമങ്ങൾ ആവിഷ്കരിച്ചത്. ഗണിതീയ രീതികളെ അവലംബിച്ചാണ് സാംഖ്യിക താപഗതികം നിലനില്ക്കുന്നതെങ്കിലും അതു നല്കുന്ന വിവരങ്ങൾ അളക്കാവുന്ന രാശികളെ അടിസ്ഥാനമാക്കിയുള്ളവയാണ്. ആറ്റം, തന്മാത്ര എന്നിവയുടെ ഗുണധർമങ്ങളെക്കുറിച്ചുള്ള അറിവിൽ നിന്ന് പദാർഥത്തിന്റെ താപഗതിക ഗുണങ്ങൾ കണ്ടെത്താൻ ഐൻസ്റ്റൈൻ, ഡിബൈ (Debye), ഗിയാവുക് (Giauque) എന്നീ ശാസ്ത്രജ്ഞർ സാംഖ്യിക താപഗതിക സിദ്ധാന്തങ്ങളാണ് പ്രയോജനപ്പെടുത്തിയത്.
അനുത്ക്രമണീയ താപഗതികം (Irreversible Thermodynamics). വളരെയേറെ ഗവേഷണം നടക്കുന്ന ആധുനിക ശാസ്ത്രമേഖലകളിലൊന്നാണിത്. സന്തുലിതാവസ്ഥയിൽ അല്ലാത്ത വ്യൂഹത്തെക്കുറിച്ചുള്ള പഠനമാണ് ഇതിലുൾപ്പെടുത്തിയിട്ടുള്ളത്. ഇവിടെ, സമതുലിതാവസ്ഥയിലല്ലാത്ത ബലങ്ങൾ വ്യൂഹത്തിൽ അനുത്ക്രമണീയ പ്രക്രിയകൾ നടക്കാൻ കാരണമാകുന്നു. അടിസ്ഥാനപരമായി, സന്തുലിതാവസ്ഥയിലുള്ള താപഗതികത്തിന്റെ തത്ത്വങ്ങൾ തന്നെയാണ് ഇവിടേയും പ്രയോഗിക്കുന്നതെങ്കിലും ഓരോ ഘടകത്തിനും പ്രത്യേകമായി ഇവ പ്രയോഗിക്കേണ്ടതുണ്ട്. വ്യൂഹത്തിന് സന്തുലിതാവസ്ഥയോട് അടുത്തു നില്ക്കുന്ന സാഹചര്യം ഉണ്ടായിരിക്കുകയും വേണം
ഇവകൂടി കാണുക
തിരുത്തുകഅവലംബം
തിരുത്തുക- ↑ http://panspermia.org/seconlaw.htm
- ↑ http://hyperphysics.phy-astr.gsu.edu/hbase/thermo/seclaw.html
- ↑ "ആർക്കൈവ് പകർപ്പ്". Archived from the original on 2009-02-21. Retrieved 2009-01-24.
| കടപ്പാട്: കേരള സർക്കാർ ഗ്നൂ സ്വതന്ത്ര പ്രസിദ്ധീകരണാനുമതി പ്രകാരം ഓൺലൈനിൽ പ്രസിദ്ധീകരിച്ച മലയാളം സർവ്വവിജ്ഞാനകോശത്തിലെ താപഗതികം എന്ന ലേഖനത്തിന്റെ ഉള്ളടക്കം ഈ ലേഖനത്തിൽ ഉപയോഗിക്കുന്നുണ്ട്. വിക്കിപീഡിയയിലേക്ക് പകർത്തിയതിന് ശേഷം പ്രസ്തുത ഉള്ളടക്കത്തിന് സാരമായ മാറ്റങ്ങൾ വന്നിട്ടുണ്ടാകാം. |