ഗാൽവനിക് സെൽ
ഗാൽവനിക് സെൽ അല്ലെങ്കിൽ വോൾട്ടാസെൽ യഥാക്രമം ലുഇഗി ഗാല്വനി, അലെസാൻഡ്രോ വോൾട്ട എന്നിവരുടെ നാമധേയത്തിലാണ് അറിയപ്പെടുന്നത്. ഇത് ഒരു വൈദ്യുത- രാസ സെൽ ആണ്. സെല്ലിനുള്ളിൽ നടക്കുന്ന റിഡോക്സ് പ്രവർത്തനത്തിൽ നിന്നാണ് വൈദ്യുത ഊർജ്ജം ഉൽപ്പാദിപ്പിക്കുന്നത്. പൊതുവായി ഇതിൽ ലവണസേതു (സാൾട്ട് ബ്രിഡ്ജ്) വിനാൽ ഘടിപ്പിക്കപ്പെട്ട വ്യത്യസ്തമായ രണ്ട് ലോഹങ്ങൾ അടാങ്ങിയിരിക്കുന്നു; അല്ലെങ്കിൽ ഓരോ ഹാഫ്- സെല്ലുകളും സുഷിരങ്ങളുള്ള സ്തരം കൊണ്ട് വേർതിരിച്ചിരിക്കും.
ആദ്യത്തെ വൈദ്യുത ബാറ്ററിയായ വോൾട്ടായിക് പൈൽ കണ്ടെത്തിയത് വോൾട്ടയാണ്. . പൊതുവായ ഉപയോഗത്തിൽ, ബാറ്ററി എന്ന പദം ഒരു ഗാൽവനിക്ക് സെല്ലിനെ മാത്രമാണ് ഉൾപ്പെടുത്തുന്നത്. എന്നാൽ, യഥാർത്ഥത്തിൽ അനേകം സെല്ലുകൾ ചേർന്നതാണ് ഒരു ബാറ്ററി. [1]
വിവരണം
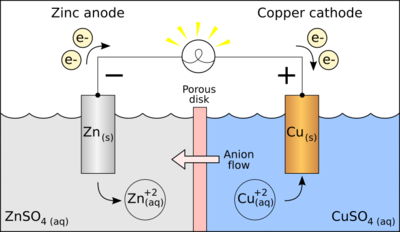
തിരുത്തുകലളിതമായ രൂപത്തിൽ, ഒരു അ൪ദ്ധ- സെല്ലിൽ ഒരു ലായനിയിൽ മുങ്ങിയിരിക്കുന്ന ഒരു സോളിഡ് മെറ്റൽ അടങ്ങിയിരിക്കുന്നു. ലായനിയിൽ ഇലക്ട്രോഡായ ലോഹത്തിന്റെ കാറ്റയോണുകളും കാറ്റയോണുകളുടെ ചാർജ്ജിനെ സംതുലനമാക്കാനുള്ള ആനയോണുകളും അടങ്ങിയിരിക്കുന്നു. തത്ത്വത്തിൽ, ഒരു ഹാഫ്- സെല്ലിൽ രണ്ട് ഓക്സിഡേഷൻ സ്റ്റേറ്റിലുള്ള ലോഹമാണ് അടങ്ങിയിരിക്കുന്നത്. ഒറ്റപ്പെട്ട ഒരു ഹാഫ്- സെല്ലിനുള്ളിൽ രാസസംതുലനത്തിലുള്ള ഓക്സിഡേഷൻ- റിഡക്ഷൻ രാസപ്രവർത്തനം നടക്കുന്നു. ഈ സാഹചര്യത്തെ താഴെത്തന്നിരിക്കുന്ന വിധത്തിൽ ചിഹ്നങ്ങൾ ഉപയോഗിച്ച് എഴുതാം:
(ഇവിടെ, "M" കാണിക്കുന്നത് ഒരു ലോഹകാറ്റയോണിനെയാണ്; "n" ഇലക്ട്രോണുകൾ നഷ്ടപ്പെട്ടതുമൂലം ചാർജ്ജിലുണ്ടാകുന്ന അസന്തുലനാവസ്ഥയുള്ള ഒരു ആറ്റം):
- Mn+ (oxidized species) + ne− ⇌ M (reduced species)
ഒരു ഗാൽവനിക്ക് സെല്ലിൽ രണ്ട് ഹാഫ്- സെല്ലുകൾ അടങ്ങിയിരിക്കുന്നു. അതായത്, ഒരു ഹാഫ്- സെല്ലിലെ ഇലക്ട്രോഡ് ലോഹം A കൊണ്ടും അടുത്ത ഹാഫ്- സെല്ലിലെ ഇലക്ട്രോഡ് ലോഹം B കൊണ്ടും ഉള്ളതാണ്. ഈ വിധത്തിൽ, രണ്ട് വ്യത്യസ്ത ഹാഫ്- സെല്ലുകളിലെ റിഡോക്സ് പ്രവർത്തനങ്ങൾ ഇവയാണ്:
- An+ + ne− ⇌ A
- Bm+ + me− ⇌ B
പൊതുവായി, അനന്തരം, ഈ രണ്ട് ലോഹങ്ങൾക്കും തമ്മിൽത്തമ്മിൽ പ്രവർത്തിക്കാൻ കഴിയും:
- m A + n Bm+ ⇌ n B + m An+
മറ്റൊരു രീതിയിൽ പറഞ്ഞാൽ, ഒരു ഹാഫ്- സെല്ലിലെ ലോഹ ആറ്റങ്ങൾക്ക് അടുത്ത ഹാഫ്- സെല്ലിലെ ലോഹകാറ്റയോണുകളുടെ റിഡക്ഷനെ പ്രേരിപ്പിക്കാനും കഴിയും. തിരിച്ചു പറഞ്ഞാൽ, ഒരു ഹാഫ്- സെല്ലിലെ ലോഹകാറ്റയോണുകൾക്ക് അടുത്ത ഹാഫ്- സെല്ലിലെ ലോഹ ആറ്റങ്ങളെ ഓക്സിഡൈസ് ചെയ്യാൻ കഴിയും. ലോഹം B യ്ക്ക് ലോഹം A യേക്കാൾ ഇലക്ട്രോനെഗറ്റിവിറ്റി കൂടുതൽ ആകുമ്പോൾ, ലോഹം B, ലോഹം A യിൽ നിന്ന് ഇലക്ട്രോണുകൾ സ്വീകരിക്കാൻ തുടങ്ങും. (അതായത്, ലോഹം B, ലോഹം A യെ ഓക്സിഡൈസ് ചെയ്യാൻ പ്രേരിപ്പിക്കുന്നു ). ഇപ്രകാരം, ഒരു ദിശയിലുള്ള രാസപ്രവർത്തനത്തിന് കാരണമാകുന്നു:
- m A + n Bm+ n B + m An+
വിവിധതരം സെല്ലുകൾ
തിരുത്തുകഇതും കാണുക
തിരുത്തുകഅവലംബം
തിരുത്തുക- ↑ "battery" (def. 4b), Merriam-Webster Online Dictionary (2008). Retrieved 6 August 2008.